
【题目】科学家预言,被称为“黑金”的“新材料之王”石墨烯将“彻底改变21世纪”。中国华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,已在世界上率先开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 有设计师建议该电池采用隔膜效果更好,可选用质子交换膜
B. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe=Li1-xCoO2+xLi+
C. 石墨烯电池通过提高储锂容量进而提高能量密度,废旧的该电池进行“放电处理”让Li+嵌入LiCoO2中而有利于回收
D. 石墨烯电池充电时LiCoO2极与电源负极相连
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】有机物种类繁多的主要原因是
A.有机物都是天然产物
B.自然界中存在着多种形式的、大量的有机物
C.有机物除含碳元素外,还含有其他多种元素
D.碳原子能与其他原子形成四个共价键,且碳原子之间也能相互成键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法不正确的是

A. ![]() 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为![]() 的反应为:
的反应为:![]()
B. 电子从![]() 流出,经外电路流向
流出,经外电路流向![]()
C. 如果将反应物直接燃烧,能量的利用率不变
D. 若该电池电路中有![]() 电子发生转移,则有
电子发生转移,则有![]() 通过质子交换膜
通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?________(“是”或“否”),理由是______。
(3)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是________。
(4)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①对比实验ⅰ和实验ⅱ可知,_________(“升高”或“降低”)pH可以提高Cr2O72-的去除率。
②实验ⅱ中Cr2O72-放电的电极反应式为___________________________________。
③实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因是_______________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AG=lgc(H+)/c(OH-),室温下用0.01mol·L1 NH3·H2O溶液滴定20.00mL 0.01mol·L1某一元酸HA,可得下图所示的结果,下列说法中错误的是

A. 该滴定实验最好选用甲基橙作指示剂
B. 整个过程中,C点时水的电离程度最大
C. 若x3=30,则有:3c(OH)=c(NH4+)+3c(H+)-2c(NH3·H2O)
D. A→C的过程中,可存在:c(A)>c(H+)>c(NH)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有3种,其分子量分别为70、72、74在天然单质中,此三种单质分子的物质的量之比为7:2:1,由此推断洗下结论中,正确的是
A.此元素有3种同位素
B.其中质量数为35的同位素原子占原子总数的1/4其中一种同位素质量数为80
C.其中一种同位素质量数为37
D.此元素单质的平均分子量为72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,下图为某种锂离子电池放电时有关离子转化关系。下列有关说法正确的是
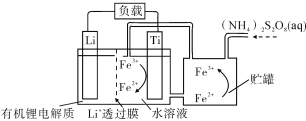
A. 电池中Li+透过膜两侧的电解质可以互换
B. 充电时,Li+通过Li+透过膜从右侧向左侧移动
C. 充电时,钛电极作阴极,电极反应式为:Fe3++e===Fe2+
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+===Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO![]() +4H2O
+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com