
【题目】某元素构成的双原子单质分子有3种,其分子量分别为70、72、74在天然单质中,此三种单质分子的物质的量之比为7:2:1,由此推断洗下结论中,正确的是
A.此元素有3种同位素
B.其中质量数为35的同位素原子占原子总数的1/4其中一种同位素质量数为80
C.其中一种同位素质量数为37
D.此元素单质的平均分子量为72
科目:高中化学 来源: 题型:
【题目】铜及其化合物在很多领域有重要的用途,如氧化亚铜(Cu2O)可做半导体材料,胆矾 (CuSO4·5H2O)用于杀菌剂,磷酸氧铜[Cu4O(PO4)2]能充当电极的活性物质。请回答下列相关问题。
(1)写出基态Cu+离子的核外电子排布式____________________,与Cu同周期且与Cu原子最外层电子数相等的元素有______________________(填元素符号)。
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为______________________。
(3)PO43-的VSEPR模型为______________________,中心原子P的杂化类型为 ___________,与其互为等电子体的离子有______________________(写出两种)。
(4)胆矾(CuSO4 5H2O)的结构示意图如下图,请结合示意图完成下列问题。

①将胆矾的化学式写成配合物的形式为______________________。
②胆矾中含有的微粒间作用力有______________________(填序号)。
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的__________(填“髙”或“低”),原因是____________________。
②CuO的晶胞结构如上图所示,可确定该晶胞中阴离子的个数为,O2-的配位数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
B. 常温下,PbI2的Ksp为2×10-6
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,被称为“黑金”的“新材料之王”石墨烯将“彻底改变21世纪”。中国华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,已在世界上率先开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 有设计师建议该电池采用隔膜效果更好,可选用质子交换膜
B. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe=Li1-xCoO2+xLi+
C. 石墨烯电池通过提高储锂容量进而提高能量密度,废旧的该电池进行“放电处理”让Li+嵌入LiCoO2中而有利于回收
D. 石墨烯电池充电时LiCoO2极与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
A. 当A、B、C物质的量浓度之比为2︰1︰2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 molL-1s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

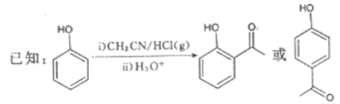
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨为放热反应,下列说法正确的是
A.断开H-H键放出能量B.形成N-H键吸收能量
C.反应物的总能量大于生成物的总能量D.反应物的总能量小于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com