
����Ŀ��G��ҩ��ϳ��е�һ����Ҫ�м��壬������G��һ�ֺϳ�·�ߣ�

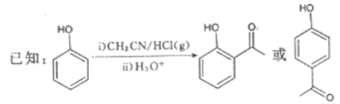
�ش��������⣺
��1��B�Ľṹ��ʽΪ__________���������������ŵ�����Ϊ__________��B����C�ķ�Ӧ����Ϊ__________��
��2��D��������__________��
��3����C��E�ϳ�F�Ļ�ѧ����ʽΪ________________________________________��
��4��D��ͬ���칹���У��ܷ���������Ӧ�ҷ��ӽṹ�к������Ļ���__________�֣����к˴Ź�����������6��壬�����֮��Ϊ1��1��1��1��1��1��ͬ���칹��Ľṹ��ʽΪ______________________ (һ�ּ���)��
��5�����������ϳ�·�ߣ���CH3CH2ClΪԭ��(�����Լ���ѡ)������Ʊ��Ͷ�ȩ(CH3CH=CH
CHO)�ĺϳ�·�ߡ�_______________
���𰸡� �ǻ����ʻ� ȡ����Ӧ ���ǻ�����ȩ
�ǻ����ʻ� ȡ����Ӧ ���ǻ�����ȩ  3
3  ��
��
![]()
��������
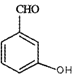
����A��C�ṹ������ʽ�����𣬽����֪�������ɵõ�B���ʵĽṹ��ʽ���京�еĹ����ŵ����ࣻ������B��C�ṹ�����������B����C�ķ�Ӧ���ͣ������ø÷�Ӧ�������Ʒ�����D�Ľṹ��ʽ������ϵͳ��������D���������ж�D��ͬ���칹��ʱ����ʱ��Ҫ�ӹ������칹��λ���칹���棬������Ҫ���������д����Ӧ�����ʵĽṹ��ʽ������C+E����Fʱ�ı仯������Ԫ�ص�ԭ���غ㣬�ɵø÷�Ӧ�Ļ�ѧ����ʽ���������֪����CH3CH2Cl�������Ŀ��֪��Ϣ���ϳ���Ҫ�Ʊ���Ŀ�����Ͷ�ȩ(CH3CH= CHCHO)��
(1)����A��C�ṹ����������֪��Ϣ��B�ķ���ʽ����֪B���ʵĽṹ��ʽ��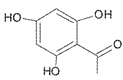 �������ʺ��еĹ��������ǻ����ʻ���B��CH3I����ȡ����Ӧ������C
�������ʺ��еĹ��������ǻ����ʻ���B��CH3I����ȡ����Ӧ������C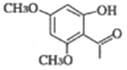 ��HI��
��HI��
(2)D��CH3I����ȡ����Ӧ�ɲ���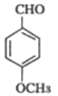 �����ƿ�֪DΪ���ǻ�����ȩ
�����ƿ�֪DΪ���ǻ�����ȩ![]() ��(3)��C
��(3)��C ��E
��E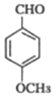 �ڼ��������¼��ȣ���Ӧ����F
�ڼ��������¼��ȣ���Ӧ����F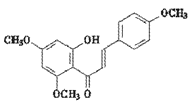 ��ˮ����Ӧ�Ļ�ѧ����ʽΪ
��ˮ����Ӧ�Ļ�ѧ����ʽΪ ��
��
(4)D��![]() ���ж���ͬ���칹�壬���е�ͬ���칹����ӽṹ�к����������ܷ���������Ӧ˵������ȩ��������
���ж���ͬ���칹�壬���е�ͬ���칹����ӽṹ�к����������ܷ���������Ӧ˵������ȩ��������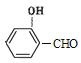 ��
��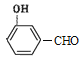 ��
��![]() ����3�֣����к˴Ź�����������6��壬�����֮��Ϊ1��1��1��1��1��1��ͬ���칹��Ľṹ��ʽΪ
����3�֣����к˴Ź�����������6��壬�����֮��Ϊ1��1��1��1��1��1��ͬ���칹��Ľṹ��ʽΪ ��
�� ��
��
(5)��CH3CH2ClΪԭ���Ʊ��Ͷ�ȩ(CH3CH= CHCHO)��������ˮ��õ��Ҵ����ٰ��Ҵ��������õ���ȩ�������������Ϣ�ϳɰͶ�ȩ������ϳ�·��Ϊ��![]() ��
��


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ�п��Ի�õ�ˮ��ʳ�Σ�������ȡþ��������ʣ�
��1���Ӻ�ˮ����ȡþ����������ͼ��ʾ��

��Ӧ�ٵ����ӷ���ʽΪ_______________________________________________
��Ӧ�ڵĻ�ѧ����ʽΪ_______________________________________________
��2����ˮ��ȡ�����̣�

���������漰������Ӧ�����ӷ���ʽ����_______________________��________________________
����������Ԫ�ر������ֱ���ԭ�ֱ�������Ŀ���ǣ�_______________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����
A. ��0.1mol��L��1CH3COOH��Һ�м�������ˮ����Һ�� ��С
��С
B. ��0.1mol��L��1�İ�ˮ�м�����������粒��壬����Һ��![]() ��С
��С
C. ��һ��Ũ�ȵĴ�����Һ�м�ˮϡ�ͣ�����Һ�� ����
����
D. 40��ʱ���ڰ���ˮ��ϵ�в���ͨ��CO2������CO2��ͨ�룬![]() ��������
��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��������������ռ���Һ��װ����ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪ1��2������˵����ȷ����

A. ���a�����Դ�ĸ�������
B. ���ʹ�Ҳ���Һ��pH��С
C. ���ӽ���ĤdΪ�����ӽ���Ĥ������������ͨ����
D. ����·��ͨ��1mol����ʱ��������ڱ�״���µ����Ϊ11.2L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йص绯ѧ֪ʶ��������ȷ����
A. ����CaO+H2O![]() Ca(OH)2�����Էų��������ȣ��ʿɰѸ÷�Ӧ��Ƴ�ԭ���
Ca(OH)2�����Էų��������ȣ��ʿɰѸ÷�Ӧ��Ƴ�ԭ���
B. ��������(������)�ĶƲ��������������ʴ��ӿ�
C. ԭ��صĵ缫������ҺpH�ı仯�����õ���ܷ�Ӧʽ���ж�
D. Ǧ���طŵ�ʱ��������ӦʽΪPbO2 +4H�� +2e��![]() Pb2�� +2H2O
Pb2�� +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ����ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ��F�������ʺ�ɫ�� ��ش�

��1��B���ǵ�Դ��__________����C���ĵ缫��ӦʽΪ____________________________________��һ��ʱ�����X����������ɫ��______________�����������ߡ���dz����
��2�����ס���װ���е�C��D��E��F�缫��ֻ��һ�ֵ�������ʱ����Ӧ���ʵ����ʵ���֮��Ϊ ______________��
��3�����ñ�װ�ø�ͭ����������HӦ����______________ ������ͭ�����������������Һ��___________ ��Һ����������Һ��pH��13ʱ����ʱ����Һ���Ϊ500mL�������жƼ���������������Ϊ________ g��������Һ��pH _____________�����������������С����������������
��4�������ձ��������������ͭ����֪���ǰ���缫������ͬ�������ɺ�����ȡ����ϴ������ɡ����������ֶ����������5.12g������ʱ��·��ͨ���ĵ���Ϊ_______mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��ʯ������Ҫ�ɷ�֮һ����һ��������ȼ�ϡ��Իش��������⣺
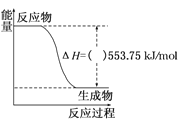
(1)��ͼ��һ����������ȫȼ������CO2��1mol H2O(l)�����е������仯ͼ��(ͼ�е�������������+����������)_____��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��_________________________
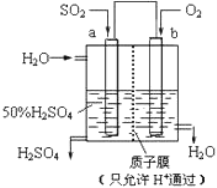
(2)������Ա��������ͼ��ʾװ���������ᡣ
����������������ܷ�Ӧ����ʽΪ_____________��b ��___________ ��(����������������)��b �缫��ӦʽΪ______________________________��a �缫����______________ (����������Ӧ��������ԭ��Ӧ��)��������������H+��_____(�� a �� b)�缫�����˶���
(3)���������缫��������������Һ�У��������ֱ�ͨ�������������ɹ��ɼ���ȼ�ϵ�أ���֪ͨ������һ��Ϊ��������缫��ӦʽΪ��_______________________������ڷŵ�����У���Һ��pHֵ��______________ ��(�����½���������������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(C1NO)���л��ϳ��е���Ҫ�Լ�������NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO(g)+C12(g)![]() 2C1NO(g)��
2C1NO(g)��
��1����֪���ֻ�ѧ���ļ����������±�(�������ȵĽṹΪCl-N=O):
��ѧ�� | N��O | Cl��Cl | Cl��N | N��O |
���ܣ�kJ/mol�� | 630 | 243 | a | 607 |
��2NO(g)+C12(g)![]() 2C1NO(g)��Ӧ�ġ�H��a�Ĺ�ϵΪ��H=____kJ/mol��
2C1NO(g)��Ӧ�ġ�H��a�Ĺ�ϵΪ��H=____kJ/mol��
��2����1L�ĺ����ܱ������г���2molNO(g)��1molC12(g)���ڲ�ͬ�¶��²��c(C1NO)��ʱ��Ĺ�ϵ��ͼA:
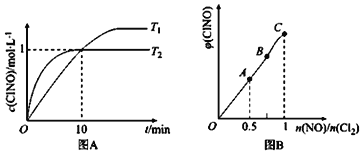
�� ��ͼA���ж�T1 ____T2���÷�Ӧ�ġ�H____0 (�>����<����=��)��
�� ��Ӧ��ʼ��10minʱNO��ƽ����Ӧ����v(NO)=______mol/(L��min)��
��3��һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(C12)�ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת����������________�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ����![]() �е�4�����ӣ��������ӵ����ʵ�����Ϊ
�е�4�����ӣ��������ӵ����ʵ�����Ϊ![]() ���������Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ����
���������Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ����
A. �������Һ�м��������ϡ�����![]() ��Һ����Һ��Ѫ��ɫ
��Һ����Һ��Ѫ��ɫ
B. �������Һ�м��������ϡ���ᣬ�����������������ܱ�ɺ���ɫ
C. ����Һ��һ����![]()
D. �������Һ�м���������![]() ��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ
��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com