
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
【答案】Mg(OH)2+2H+=Mg2++2H2OMgCl2(熔融)![]() Mg+Cl2↑Cl2+2Br-=2Cl-+Br2Br2+SO2+2H2O = 4H++2Br-+SO42-富集溴元素
Mg+Cl2↑Cl2+2Br-=2Cl-+Br2Br2+SO2+2H2O = 4H++2Br-+SO42-富集溴元素
【解析】
(1)因反应①是Mg(OH)2与盐酸反应生成氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为Mg(OH)2+2H+═Mg2++2H2O;反应②是电解熔融MgCl2:MgCl2(熔融)![]() Mg+Cl2↑,故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)
Mg+Cl2↑,故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)海水提取溴过程中,在海水中通入氯气氧化溴离子,置换出溴,然后通过热空气吹出溴,吹出来的溴用二氧化硫还原,得到溴化氢溶液,最后再用氯气氧化得到溴单质。涉及的反应有:①Cl2+2Br-=2Cl-+Br2、②Br2+SO2+2H2O = 4H++2Br-+SO42-,该流程中溴元素被氧化又被还原又被氧化的目的是富集溴元素,故答案为:Cl2+2Br-=2Cl-+Br2;Br2+SO2+2H2O = 4H++2Br-+SO42-;富集溴元素。


科目:高中化学 来源: 题型:
【题目】(1)向K2Cr2O7的水溶液中加入Ba(NO3)2溶液,产生难溶性黄色沉淀BaCrO4,说明K2Cr2O7的水溶液中存在如下平衡:__________________________________________,产生沉淀后溶液PH变________.已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色,往上述溶液中加入氢氧化钠溶液呈_________色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动。
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应的离子反应方程式:____________________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用 B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用 D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | <>2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________淀粉溶液的作用是____________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,试推测该实验结论: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
A. 物质A、B的转化率之比为a∶b
B. 起始时刻和达到平衡后容器中的压强比为(a+b)∶![]()
C. 若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol C
D. 当v正(A)=2v逆(B)时,可确定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13·6H2O)的工艺流程如下,下列说法错误的是
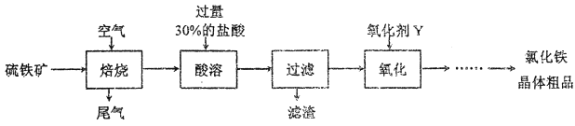
A. 将硫铁矿粉碎再焙烧的目的是加快反应速率
B. 酸溶时需保持盐酸过量的目的是提高铁元素的浸出率
C. 氧化剂Y可以是Cl2不能是H2O2
D. 上述流程中的FeS2可用FeS来代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:
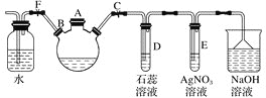
(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的有机化学方程式为______________________。
(2)D、E试管内出现的现象分别为:D.______, E.__________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
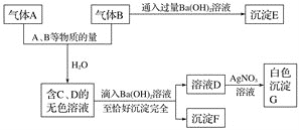
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

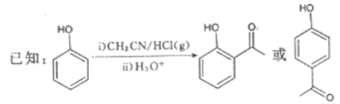
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com