
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)
【答案】MnO2+2FeSO4+2H2SO4===MnSO4+Fe2(SO4)3+2H2O 充分氧化过量的Fe2+ 5.3 CuS、ZnS MnO2+H2O+e-===MnO(OH)+OH-(或2MnO2+H2O+2e-===Mn2O3+2OH-) Mn2+-2e-+2H2O===MnO2+4H+ 94.6%
【解析】
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,亚铁离子被氧化为铁离子,酸浸时发生的主要反应的化学方程式为MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
综上所述,本题答案是:MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O。
(2)由于酸浸过程中加入了过量的亚铁离子,因此搅拌可以使溶液充分接触氧气使亚铁离子被氧化,故搅拌的目的是:充分氧化过量的亚铁离子;比较氢氧化铝和氢氧化铁的Ksp可知, Fe3+先沉淀, Al3+后沉淀,要想使Fe3+和Al3+恰好完全沉淀,则c(Al3+)小于等于10-5 mol·L-1,根据Ksp=c(Al3+)×c3(OH-)=10-31,10-5×c3(OH)=10-31,c(OH-)≈10-8.7,c(H+)=10-5.3,pH=5.3;因此加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全;
综上所述,本题答案是:充分氧化过量的Fe2+;5.3。
(3)加入氨水后过滤所得滤液中还含有铜离子、锌离子,再加入硫化锰后,铜离子、锌离子与硫离子结合产生更难溶的CuS、ZnS沉淀,因此滤渣B的成分是CuS、ZnS;
综上所述,本题答案是:CuS、ZnS。
(4)碱性环境下,MnO2在正极发生还原反应,生成MnO(OH)或Mn2O3,电极反应式为MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-);
综上所述,本题答案是:MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-),
(5)酸性环境下,Mn2+在阳极发生氧化反应生成MnO2,反应式为Mn2+-2e-+2H2O=MnO2+4H+ ;
综上所述,本题答案是:Mn2+-2e-+2H2O=MnO2+4H+。
(6)根据反应:MnO2+4H++2I-= Mn2++2H2O+ I2,I2+2S2O32-=2I-+S4O62-得到关系MnO2~I2~2 S2O32-;由题干可知,n(MnO2)=1/2×(100/10)×0.025×0.0800 mol =0.01mol,其质量为0.01 mol×87g/mol=0.87g;因此样品纯度为0.87g÷0.92g×100%=94.6%;
综上所述,本题答案是:94.6%。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)反应的平衡常数表达式K=_____________;根据下图,升高温度,K值将__________(填“增大”、“减小”或“不变”)。

(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______ (填字母)。
a.v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)______________。
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
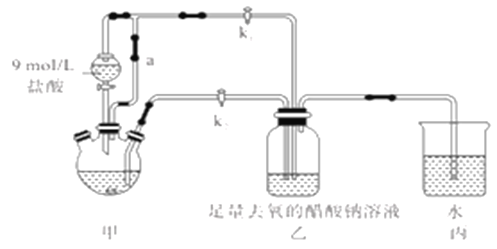
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中![]() 减小
减小
C. 向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D. 40℃时,在氨—水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. 左侧a极与电源的负极相连
B. 电解使右侧溶液的pH减小
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. 当电路中通过1mol电子时,气体甲在标准状况下的体积为11.2L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
(2)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
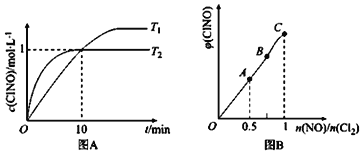
① 由图A可判断T1 ____T2,该反应的△H____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=______mol/(L·min)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com