
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中![]() 减小
减小
C. 向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D. 40℃时,在氨—水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
【答案】B
【解析】
A.加水稀释促进CH3COOH 的电离,n(H+)增大,n(CH3COOH)减小,则溶液中 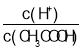 增大,故A错误;
增大,故A错误;
B.向0.1mol·L-1的氨水中加入少量硫酸铵固体,c(NH4+)增大,抑制NH3H2O的电离,c(OH-)减小,c(NH3H2O)增大,故![]() 减小,故B正确;
减小,故B正确;
C.已知Ka=(CH3COO-)c(H+)/c(CH3COOH),温度不变,Ka不变,又知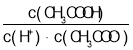 =1/Ka,故
=1/Ka,故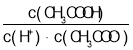 不变,故C错误;
不变,故C错误;
D.已知Kb=c(NH4+)c(OH-)/c(NH3H2O),温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则![]() 不断减小,故D错误;
不断减小,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
A. 物质A、B的转化率之比为a∶b
B. 起始时刻和达到平衡后容器中的压强比为(a+b)∶![]()
C. 若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol C
D. 当v正(A)=2v逆(B)时,可确定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
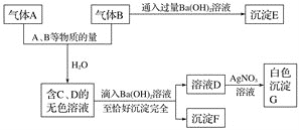
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是五种银盐的溶度积常数(25°C),下列说法错误的是

A. 用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂
B. 将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀
C. 氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

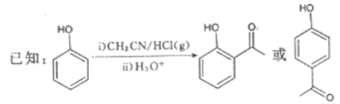
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2 ===2AB3反应来说,以下反应速率表示反应最快的是
A. v(AB3)=0.5 mol·L-1·min-1 B. v(A2)=0.4mol·L-1·min-1
C. v(B2)=0.6 mol·L-1·min-1 D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com