
【题目】下表是五种银盐的溶度积常数(25°C),下列说法错误的是

A. 用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂
B. 将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀
C. 氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动
【答案】A
【解析】
A.硫化银的溶度积比氯化银小,用硝酸银溶液测定Cl-含量时,不能用硫化钠做指示剂;
B.硫化银的溶度积比氯化银小,从沉淀平衡移动的角度分析;
C.结构相似的难溶性盐,溶度积越小,溶解度越小;
D.难溶电解质的溶解平衡是一定条件下的动态平衡。
A. 由于硫化银的溶度积比氯化银小,所以用硝酸银溶液测定Cl-含量时,不能用硫化钠做指示剂,应该用铬酸钾作指示剂,所以A选项是错误的;
B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,所以B选项是正确的;
C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可以知道AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,所以C选项是正确的;
D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,所以D选项是正确的。
故答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:

(1)指出从海藻中提取I2的实验操作名称:
①____________,③__________②的离子方程式__________,。
(2)提取碘的过程中,可供选择的有机溶剂是(____)。
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(3)为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。
(4)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处__________。
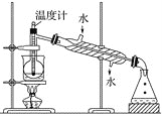
(5)进行蒸馏操作时,使用水浴加热的原因是_________________,最后晶态碘在________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中![]() 减小
减小
C. 向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D. 40℃时,在氨—水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A. CuS的溶解度比MnS的溶解度小
B. 该反应达到平衡时:c(Cu2+)=c(Mn2+)
C. 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D. 该反应平衡常数:K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. 左侧a极与电源的负极相连
B. 电解使右侧溶液的pH减小
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. 当电路中通过1mol电子时,气体甲在标准状况下的体积为11.2L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. 由于CaO+H2O![]() Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
B. 当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快
C. 原电池的电极附近溶液pH的变化可以用电池总反应式来判断
D. 铅蓄电池放电时的正极反应式为PbO2 +4H+ +2e-![]() Pb2+ +2H2O
Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
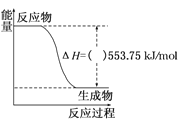
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
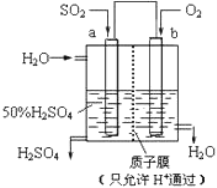
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3A(g)+B(g)![]() 2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是
2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是

①增大A的浓度 ②升高温度 ③增大D浓度 ④加入催化剂 ⑤恒温下,缩小反应容器体积 ⑥加入稀有气体,保持容器内压强不变
A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com