
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A. CuS的溶解度比MnS的溶解度小
B. 该反应达到平衡时:c(Cu2+)=c(Mn2+)
C. 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D. 该反应平衡常数:K=![]()
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为______________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验____________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g)ΔH=-
O2(g)===H2O(g)ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l)ΔH=-
O2(g)===H2O(l)ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:kJ)为
A. 0.4Q1+0.05Q3B. 0.4Q1+0.05Q2C. 0.4Q1+0.1Q3D. 0.4Q1+0.2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是五种银盐的溶度积常数(25°C),下列说法错误的是

A. 用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂
B. 将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀
C. 氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
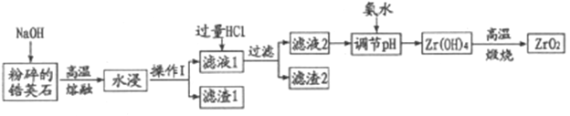
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com