
【题目】元素周期表中共有7个周期和18个族。(______)
A.正确 B.错误
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A. CuS的溶解度比MnS的溶解度小
B. 该反应达到平衡时:c(Cu2+)=c(Mn2+)
C. 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D. 该反应平衡常数:K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. 由于CaO+H2O![]() Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
B. 当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快
C. 原电池的电极附近溶液pH的变化可以用电池总反应式来判断
D. 铅蓄电池放电时的正极反应式为PbO2 +4H+ +2e-![]() Pb2+ +2H2O
Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. 混合气体的密度保持不变D. 每消耗1 mol SO3的同时生成1 molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
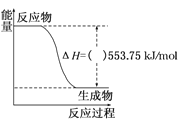
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
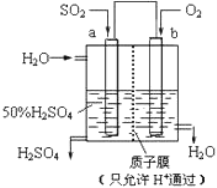
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
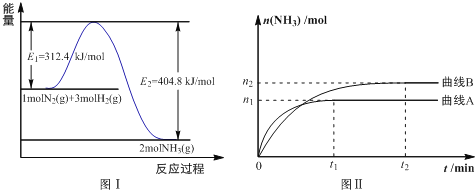
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
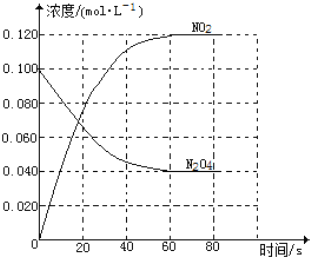
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的H2可由煤和水蒸气反应而制得,其中一步的反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH< 0,下列措施中,能提高CO转化率的是( )
A.增大压强B.升高温度C.增大水蒸气浓度D.增大CO浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com