
【题目】合成氨为放热反应,下列说法正确的是
A.断开H-H键放出能量B.形成N-H键吸收能量
C.反应物的总能量大于生成物的总能量D.反应物的总能量小于生成物的总能量
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,22 g CO2的体积是________L,与________ g N2含有相同的分子数。
(2)等物质的量的CO和CO2其质量之比是________,分子数之比是________。
(3)同温同压下,同体积的氨气和硫化氢(H2S)气体的质量比为________;同质量的氨气和硫化氢气体体积比为________,其中含有的氢原子数目比为________;若二者氢原子数相等,则它们的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?________(“是”或“否”),理由是______。
(3)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是________。
(4)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①对比实验ⅰ和实验ⅱ可知,_________(“升高”或“降低”)pH可以提高Cr2O72-的去除率。
②实验ⅱ中Cr2O72-放电的电极反应式为___________________________________。
③实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因是_______________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有3种,其分子量分别为70、72、74在天然单质中,此三种单质分子的物质的量之比为7:2:1,由此推断洗下结论中,正确的是
A.此元素有3种同位素
B.其中质量数为35的同位素原子占原子总数的1/4其中一种同位素质量数为80
C.其中一种同位素质量数为37
D.此元素单质的平均分子量为72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,下图为某种锂离子电池放电时有关离子转化关系。下列有关说法正确的是
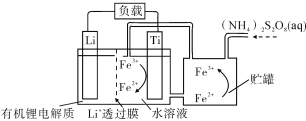
A. 电池中Li+透过膜两侧的电解质可以互换
B. 充电时,Li+通过Li+透过膜从右侧向左侧移动
C. 充电时,钛电极作阴极,电极反应式为:Fe3++e===Fe2+
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+===Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水是氧化剂的是( )
A.2F2 +2H2O=4HF+O2
B.Cl2+H2OHCl+HClO
C.CaO+H2O=Ca(OH)2
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com