
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+,Fe2+,Cl-,![]()
B.石蕊溶液呈红色的溶液:![]() ,Ba2+,
,Ba2+,![]() ,Cl-
,Cl-
C.pH=12的溶液:K+,Na+,CH3COO-,Br-
D.与铝反应产生大量氢气的溶液:Na+,K+,![]() ,
,![]()
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分:Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
(1)上述流程中所采取的实验措施能加快反应速率有_____________。
(2)酸浸时,磷精矿中Ca5(PO4)3(OH)与H2SO4反应的化学方程式为_____________。
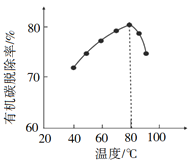
(3)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因______。
(4)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3代替CaCO3可进一步提高硫的脱除率,原因是_____。向粗磷酸中加入BaCO3脱硫,发生反应的离子方程式是_____。
(5)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L-1 NaOH 溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c L,精制磷酸中H3PO4的质量分数是_____。(已知摩尔质量为98g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物AH的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
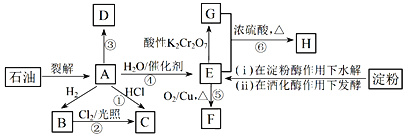
请回答下列问题:
(1)E官能团的电子式为_____。
(2)关于有机物A、B、C、D的下列说法,不正确的是____(选填序号)。
a. A、B、C、D均属于烃类
b. B的同系物中,当碳原子数≥4时开始出现同分异构现象
c. 等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
d. B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
(3)写出下列反应的化学方程式:
反应③:____________________________;
反应⑥:_____________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:_______,并说明理由:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
A. 混合气体的密度不变 B. 单位时间内生成n molD,同时生成n molC
C. 混合气体的平均相对分子质量不变 D. C(g)的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯( )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是

A.m为电源负极
B.BPE的b端比a端的电势高
C.BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH-
D.BPE的b端到中心的不同位置,能形成组成不同的铜镍合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com