
【题目】双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是

A.m为电源负极
B.BPE的b端比a端的电势高
C.BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH-
D.BPE的b端到中心的不同位置,能形成组成不同的铜镍合金
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
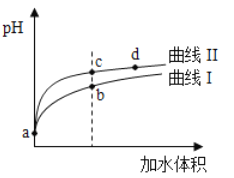
A.曲线I代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+,Fe2+,Cl-,![]()
B.石蕊溶液呈红色的溶液:![]() ,Ba2+,
,Ba2+,![]() ,Cl-
,Cl-
C.pH=12的溶液:K+,Na+,CH3COO-,Br-
D.与铝反应产生大量氢气的溶液:Na+,K+,![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应.
反应①:4NH3 (g)+6NO(g) ![]() 5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
反应②:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) H2=?
5N2(g)+3O2(g)+6H2O(l) H2=?
反应③:2NO(g)+O2(g) ![]() 2NO2(g) H3=-113.0kJ·mol一1
2NO2(g) H3=-113.0kJ·mol一1
(1)反应②的H2==_____________。
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。
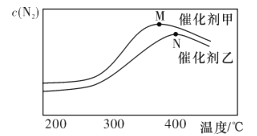
①反应①的平衡常数的表达式K=________。相同温度下.在催化剂甲的作用下反应的平衡常数______(填“大于”“小于”或“等于”)在催化剂乙的作用下反应的平衡常数。
②N点后N2浓度减小的原因可能是_____________________。
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为____,达平衡所用时间为5 min.则用NO表示此反应0~5 min内的平均反应速率为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、Na2 SO4 、KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
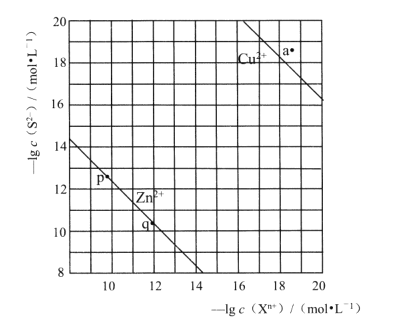
A.Ksp(CuS)的数量级为10-37
B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量NaS固体,溶液组成由p向q方向移动
D.H2S+Zn2+![]() ZnS + 2H+平衡常數很大,反应趋于完全
ZnS + 2H+平衡常數很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯环上的羟基具有酸性。下列关于有机化合物M和N的说法正确的是( )
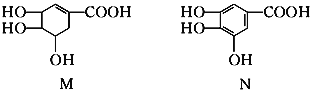
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.M、N分子中都含有苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。

(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置1分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g) 口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及烧杯外,为完成实验还需要的仪器有:______________。
Ⅱ利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。
(2)滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-===S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____,C原子的杂化形式为______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com