
【题目】用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、Na2 SO4 、KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
【答案】C
【解析】试题分析:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42﹣完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42﹣)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=![]() n(SO42﹣),n(Na2SO4)=n(SO42﹣),n[KAl(SO4)2]=
n(SO42﹣),n(Na2SO4)=n(SO42﹣),n[KAl(SO4)2]=![]() n(SO42﹣),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,据此计算.
n(SO42﹣),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,据此计算.
解:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42﹣完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42﹣)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=![]() n(SO42﹣),n(Na2SO4)=n(SO42﹣),n[KAl(SO4)2]=
n(SO42﹣),n(Na2SO4)=n(SO42﹣),n[KAl(SO4)2]=![]() n(SO42﹣),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,所以三种硫酸盐的物质的量浓度之比为c[Fe2(SO4)3]:c(Na2SO4):c[KAl(SO4)2]=
n(SO42﹣),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,所以三种硫酸盐的物质的量浓度之比为c[Fe2(SO4)3]:c(Na2SO4):c[KAl(SO4)2]=![]() n(SO42﹣):n(SO42﹣):
n(SO42﹣):n(SO42﹣):![]() n(SO42﹣)=2:6:3.
n(SO42﹣)=2:6:3.
故选:C.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组中的两种有机物,可能是:a.相同的物质、b.同系物、c.同分异构体,请判断它们之间的关系(用字母填空):
①间二甲苯和乙苯____________;②2-甲基丁烷和丁烷_________;
(2)按要求完成下列问题:
①甲基的电子式___________。
②反式2-丁烯的结构简式___________
(3)请写出下列高分子化合物的单体结构简式:
① ___________________________________________;
___________________________________________;
②![]() ________________________________
________________________________
(4)写出乙醛与新制氢氧化铜反应的化学方程式:_________________________________
(5)写出两分子甘氨酸形成二肽的化学方程式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,11.2 L H2和14 g N2所含原子数相同;
③28 g CO的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. 仅⑤⑥ B. 仅②⑤⑥
C. 仅②③⑤⑥ D. 仅①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
已知A是芳香烃,苯环上只有一个取代基,A完全加氢后分子中有两个甲基,E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色,其可以用来合成新型药物H,合成路线如图所示。

已知:

请回答下列问题:
(1)写出有机物A的结构简式:____________。有机物D中存在的官能团名称为_______________。
(2)上述反应过程中属于取代反应的有________________(填序号)。
(3)有机物H在一定条件下可以聚合形成高分子,写出该聚合物的结构简式:_______________________。
(4)写出H在氢氧化钠催化作用下的水解方程式:_________________________。
(5)有机物E有多种同分异构体,写出符合下列条件的同分异构体的结构简式:_________________。
a.存在苯环且苯环上核磁共振氢谱只有2组峰值
b.与新制Cu(OH)2悬浊液作用产生砖红色沉淀
c.加入FeCl3溶液显色
(6)参照H的上述合成路线,设计一条由石油产品和NH2—CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线:___________________________________________________________________(需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890 kJ·mol1
CO2(g)+2H2O(l) ΔH=890 kJ·mol1
②2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2O(l) ΔH=3116.7 kJ·mol1
4CO2(g)+6H2O(l) ΔH=3116.7 kJ·mol1
③C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH=1409.6 kJ·mol1
2CO2(g)+2H2O(l) ΔH=1409.6 kJ·mol1
④2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=2596.7 kJ·mol1
4CO2(g)+2H2O(l) ΔH=2596.7 kJ·mol1
⑤C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2217.8 kJ·mol1
3CO2(g)+4H2O(l) ΔH=2217.8 kJ·mol1
现由上述五种烃中的两种组成的混合气体2 mol,经充分燃烧后放出3037.6 kJ热量,则下列哪些组合是不可能的
A.C2H4和C2H6 B.C2H2和C3H8 C.C2H6和C3H8 D.C2H6和CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. 碳酸钠的水解反应:CO32-+ H3O+![]() HCO3-+ H2O
HCO3-+ H2O
B. 氢氧化铁胶体的制备:Fe3+ + 3OH-=Fe(OH)3(胶体)
C. 偏铝酸钠中滴加碳酸氢钠溶液: AlO2- +HCO3- +H2O= Al(OH)3↓ + CO32-
D. 碱性氢氧燃料电池的正极反应式:4OH--4e-=2H2O + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 如图连接装置,检査装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入—段时间的O2
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
请回答:
⑴仪器a的作用为______________________。
(2)步骤Ⅲ中,停止加热后还需继续通入一段时间的O2,其目的为__________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________________。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为___________________。
(5)问题讨论:有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案________(填“是”或“否”)合理,原因为_______________________。
(二)探究反应后D装置所得溶液中含硫化合物的组成。
理论推测:溶液中除含有Na2SO4外,还可能含有Na2SO3。
实验探究:滴定法测定溶液中Na2SO3的含量。
可供选择的试剂:①0.10 mol L-1 KmnO4酸性溶液 ②30%H2O2
③0.10 mol L-1 KI淀粉溶液
(6)所选试剂为___________(填序号);所选试剂应装在_____________(填“酸式”或“碱式”)滴定管中。
⑦所利用的反应原理为__________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:
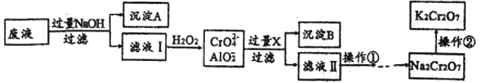
已知:H++CrO2-+H2O![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
H、C、N、O、W、Fe、V都是生活与化学工业中常见元素,请回答下列问题:
⑴碳负离子CH3-的空间构型为_______;根据等电子原理,NO+的电子式为________。
⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是________;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为______。

(3)钒可用于人工合成的二价钒固氮美酶(结构如图甲)。钒固氮酶中钒的配位原子有__________(填元素符号)。
(4)烟酰胺(结构如图乙)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有______,1 mol该分子中含σ键的数目为________________。
(5)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有______个,假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________。
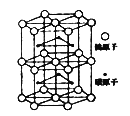
(6)12 g石墨烯(结构如图丙)中含有的正六边形的物质的量为_____mol;请你预测硅是否容易形成类似石墨烯的结构,并说明理由____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com