
【题目】
H、C、N、O、W、Fe、V都是生活与化学工业中常见元素,请回答下列问题:
⑴碳负离子CH3-的空间构型为_______;根据等电子原理,NO+的电子式为________。
⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是________;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为______。

(3)钒可用于人工合成的二价钒固氮美酶(结构如图甲)。钒固氮酶中钒的配位原子有__________(填元素符号)。
(4)烟酰胺(结构如图乙)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有______,1 mol该分子中含σ键的数目为________________。
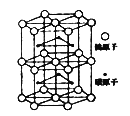
(5)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有______个,假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________。
(6)12 g石墨烯(结构如图丙)中含有的正六边形的物质的量为_____mol;请你预测硅是否容易形成类似石墨烯的结构,并说明理由____________________。
【答案】 三角锥形 [![]() ]+ Fe3+ [Cu(H2O)4]2+ N、S sp3,sp2 15NA 6 6
]+ Fe3+ [Cu(H2O)4]2+ N、S sp3,sp2 15NA 6 6 ![]() 0.5 不容易,硅原子半径大于碳原子半径,且3p轨道不易重叠形成键
0.5 不容易,硅原子半径大于碳原子半径,且3p轨道不易重叠形成键
【解析】(1)碳负离子CH3-中碳原子的价层电子对数=3+(4+1-3×1)/2=4,含有一对孤对电子,所以空间构型为三角锥形;NO+与氮气互为等电子体,则根据等电子原理,NO+的电子式为![]() 。⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,所以未成对电子数最多的是Fe3+;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+。(3)由图可知,钒固氨酶中钒的配位原子有S与N;(4)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、,2个C-N键、4个双键,单键为σ键,双键含有1个σ键、1个π键,故分子中含有σ键为15,故lmol该分子中含σ键数目为15NA;(5)在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个;结构中W原子数目为6、C原子数目为6,则晶胞的质量为
。⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,所以未成对电子数最多的是Fe3+;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+。(3)由图可知,钒固氨酶中钒的配位原子有S与N;(4)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、,2个C-N键、4个双键,单键为σ键,双键含有1个σ键、1个π键,故分子中含有σ键为15,故lmol该分子中含σ键数目为15NA;(5)在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,以体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个;结构中W原子数目为6、C原子数目为6,则晶胞的质量为![]() ,则
,则![]() =Vcm3×b g/cm3,故NA=6M/bV;(6) 12g石墨烯中碳原子的物质的量为12g÷12g/mol=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×1/3=2,则含有的正六边形数目为1mol×1/2×NAmol-1=0.5NA,物质的量是0.5mol;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,因此硅不容易形成类似石墨烯的结构。
=Vcm3×b g/cm3,故NA=6M/bV;(6) 12g石墨烯中碳原子的物质的量为12g÷12g/mol=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×1/3=2,则含有的正六边形数目为1mol×1/2×NAmol-1=0.5NA,物质的量是0.5mol;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,因此硅不容易形成类似石墨烯的结构。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、Na2 SO4 、KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要80mL 0.50mol/L稀硫酸,某同学用98%的浓硫酸(密度为1.84g/mL)进行配制.
(1)容量瓶上需标有以下五项中的________. (填字母)
A.温度 B.浓度 C.容量 D.压强 E.刻度线
(2)正确的操作顺序为_________(字母表示,每个字母只能用一次);
A.用少量水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡;
B.用量筒准确量取浓硫酸_______mL,沿器壁缓缓注入盛有少量水的烧杯中,用玻璃棒慢慢搅拌,使其混合均匀;
C.将已冷却的硫酸溶液沿玻璃棒缓缓注入____(填容量)容盘瓶中;
D.将容量瓶盖紧,颠倒摇匀;
E.改用____加水,使溶液凹液面恰好与刻度线相切;
F.继续往容量瓶内小心加水,直到液面至刻度线下________处.
(3)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是(填序号)_____。
① 量取浓硫酸的量筒用蒸馏水洗涤2-3次,并把洗涤液转入容量瓶
② 用量筒最取浓硫酸时俯视刻度线
③ 容里瓶使用时未干燥.
④ 溶解后未经冷却就移液
⑤ 定容时仰视刻度线
⑥ 定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.所有的电子在同一区域里运动
B.能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,1s、2s、3s所能容纳的电子数越来越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将0.1molCl2通入一定量水中,HClO、Cl-、ClO-粒子数之和为0.2NA
B. 12gNaHSO4固体中含阳离子数为0.1NA
C. 将1molFe(OH)3加入到含3molHI的溶液完全反应后,溶液中所含I- 的数目为3NA
D. 已知合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合反应是制备新型材料的重要途径。由天然橡胶的单体A制备的化合物F、K发生加聚反应可得到新型高分子材料。

已知:①E的结构简式为 ,红外光谱法测得F、K分子均含有甲基。
,红外光谱法测得F、K分子均含有甲基。
②![]()
(1)A按系统命名法的名称为_____________________。
(2)反应①的反应类型为________________,设计步骤①③目的是______________。
(3)有机物甲的结构简式为_______________。
(4)写出F与K按物质的量1:1共聚形成高分子化合物的化学方程式为______________________________。
(5)有机物乙是J的同系物,且比J少一个碳原子,乙有多种同分异构体,其中能满足下列条件的同分异构体有_________种。
a.含有酚羟基
b.能发生水解反应且能发生银镜反应
c.苯环上的一氯代物只有一种
d.核磁共振氢谱有5组峰
(6)参照上述合成路线,设计一条由乙二醇和苯为原料(无机试剂任选)制备苯乙酸 (![]() )的合成路线_________。
)的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2锂硫电池的总反应为: 2Li+S
C+LiCoO2锂硫电池的总反应为: 2Li+S![]() Li2S。有关上述两种电池说法正确的是( )
Li2S。有关上述两种电池说法正确的是( )

A. 锂离子电池放电时,Li+向负极迁移
B. 理论上两种电池的比能量相同
C. 锂硫电池充电时,锂电极发生还原反应
D. 右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某加碘食盐包装袋上的配料表和部分图表文字(I为碘的元素符号)

(1)由此得到的信息和作出的推测正确的是_______________
A.此食盐是非电解质
B. “菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
C. 1 kg 此食盐中含碘酸钾(35±15 ) mg
D. “加碘食盐”中的“碘”是指碘单质
E.在食盐中不加入KI的原因可能是能被氧化
(2)已知碘元素最高和最低价分别为一1和+7价,则IO3-在氧化还原中____________(填序号)。
①只能做氧化剂 ② 只能做还原剂 ③ 既可以做氧化剂也可以做还原剂
(3)根据以下化学方程式写出离子方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O__________________;该反应中氧化产物和还原产物的质量比为_________;若生成152.4gI2,转移的电子数为_________;根据以上反应推测,一个氧化还原反应的发生,除了跟物质的氧化性和还原性有关,还和____________有关。
(4)要利用(3)提供的反应原理检验食盐中的碘元素,采用下列方法:
①反应后加入________溶液,溶液变蓝;
②反应后溶液放入试管中加入少量CC14 震荡后静置,若下层显_______色,证明有I2生成。
③ 家庭条件下证明在食盐中存在IO3-进行上述实验时必须使用的物质是________。
a.自来水 b.蓝色石蕊试纸 c.碘化钾淀粉试纸 d.淀粉 e.食糖 f.食醋 g.白酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com