
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
A. 混合气体的密度不变 B. 单位时间内生成n molD,同时生成n molC
C. 混合气体的平均相对分子质量不变 D. C(g)的物质的量浓度不变
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】NaClO溶液是一种纺织工业用漂白剂,可用一定比例NaOH、Na2CO3的混合溶液和Cl2反应制备。
(1)NaHCO3的存在能增强NaClO溶液的稳定性。Cl2与混合溶液中Na2CO3反应制备NaClO,同时生成NaHCO3,其化学方程式为___。
(2)NaClO溶液中若含有NaClO3会影响产品的品质。测定碱性NaClO样品中NaClO3物质的量浓度的方法如下:取20.00mLNaClO溶液试样,加入过量H2O2,充分反应后,加热煮沸,冷却至室温,加入硫酸酸化,再加入0.1000mol·L-1FeSO4标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定过量的FeSO4溶液至终点(Cr2O72-被还原为Cr3+),消耗该溶液25.00mL。
已知:ClO3-在碱性条件下性质稳定,在酸性条件下表现出强氧化性;ClO3-+Fe2++H+—Cl-+Fe3++H2O(未配平)。
①加入过量H2O2的目的是__。
②实验中若缺少加热煮沸步骤,所测NaClO3物质的量浓度会有较大误差,原因可能是___(答出一个即可)。
③计算样品中NaClO3物质的量浓度___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取10 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
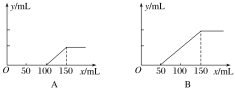
(1)在A情况下,溶质是________________(填化学式),其物质的量之比为________。
(2)原氢氧化钠溶液的物质的量浓度为________________。
II.足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是__________________。
III.向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL浓度为2.0 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL的气体(标准状况),所得溶液中加入KSCN溶液后无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是________,解题依据是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为某学生在实验室中制备高锰酸钾晶体的流程图。
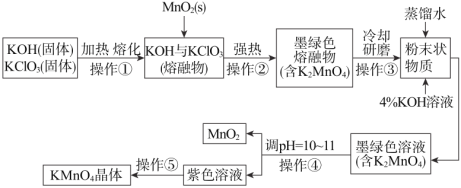
根据上图回答下列问题:
(1)操作①和②均需在坩埚中进行,根据实验实际应选择坩埚为_____(填字母);
a.石英坩埚 b.氧化铝坩埚 c.铁坩埚
(2)已知:3MnO42-+2H2O2MnO4-+MnO2+4OH-。操作④中通CO2调pH=10~11,其目的是_____;
(3)得到墨绿色溶液后,也可用如图所示方法制备KMnO4,电极均为铂电极。
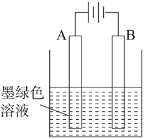
①A极上的电极反应式为_____;
②这种方法与上面的方法相比,其优点是_____;
(4)实验室中,可用0.10mol/L,草酸作标准溶液,利用下述反应,测定所得KMnO4晶体的纯度。5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
取agKMnO4晶体样品配制成100mL溶液。每次取20.00mL于锥形瓶中进行滴定实验两次。两次实验所用草酸标准溶液的体积分别为22.15mL和22.17mL,由此求得KMnO4晶体的纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
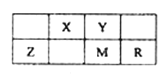
A. 元素的非金属性次序为:Y>X>M
B. 气态氢化物稳定性:M>R
C. Z的氧化物可以做光导纤维
D. 最D高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+,Fe2+,Cl-,![]()
B.石蕊溶液呈红色的溶液:![]() ,Ba2+,
,Ba2+,![]() ,Cl-
,Cl-
C.pH=12的溶液:K+,Na+,CH3COO-,Br-
D.与铝反应产生大量氢气的溶液:Na+,K+,![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
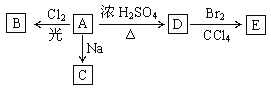
①A分子中的官能团名称是_______。A的同分异构共有_________种(包括A本身)
②A只有一种一氯取代物B。写出由A转化为B的化学方程式:_________________。
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。则F的结构简式是____________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(填序号)_________
① 加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________。
(3)A和“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、Na2 SO4 、KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从粉煤灰(含莫来石、石英等)中回收![]() 的一种工艺流程如下:
的一种工艺流程如下:
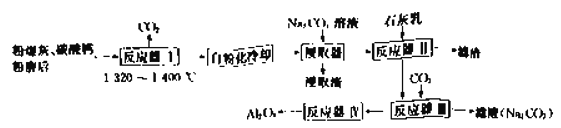
(1)经反应器I可使莫来石和石英转化为![]() (硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的
(硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的![]() 得到活化。
得到活化。
(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是_______。
(3)浸取器中,适量增大![]() 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为![]() 的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
(4)反应器Ⅲ中发生反应的离子方程式为:__________________________________。
(5)反应器Ⅳ采取工艺方法是_____________________;上述工艺流程中可以循环使用的物质是_______________________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com