
����Ŀ��I���ֱ�ȡ�����ʵ���Ũ�ȵ�����������Һ��100 mL����ͨ��һ������CO2�����ֱ��ȡ10 mL��Һ����������ε���0.2 mol��L��1�����ᣬ�ڱ�״���²���CO2�����(y��)����������������(x��)�Ĺ�ϵ����ͼ(��A��B�������)��
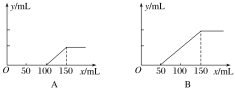
��1����A����£�������________________(�ѧʽ)�������ʵ���֮��Ϊ________��
��2��ԭ����������Һ�����ʵ���Ũ��Ϊ________________��
II���������������ֱ�Ͷ�뵽������������ʵ���Ũ�ȵ����������������Һ�У�����H2�����֮����__________________��
III����һ������Fe��FeO��Fe2O3�Ļ�����м���100 mLŨ��Ϊ2.0 mol��L��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224 mL������(��״��)��������Һ�м���KSCN��Һ����Ѫ��ɫ���֡�����������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ܵõ�����������________,����������_________________
���𰸡�NaOH��Na2CO3 1:1 3mol/L 1:3 5.6g ԭ���غ㣨�������غ㣩
��������
I����NaOH��Һ��ͨ��CO2������CO2��ͨ�룬������4�������NaOH��Na2CO3��Na2CO3��Na2CO3��NaHCO3��NaHCO3��������뷴Ӧ�����Һ�У�HCl�Ⱥ�NaOH��Ӧ���ٺ�Na2CO3��Ӧ��CO32-+H+=HCO3-������ٷ���HCO3-+H+=H2O+CO2����
II�������������ᡢ�������Ʒ�Ӧ�ķ���ʽ���
III������ԭ���غ���
I����1����A����£�����100mL��HCl�����ʵ���Ϊ0.1L��0.2 mol��L��1=0.02mol�������ʼ������ų����ټ���50mL���ᣨHCl�����ʵ���Ϊ0.05L��0.2 mol��L��1=0.01mol������ﵽ��࣬����������NaOH��Na2CO3����������ķ���ʽ��0.01molHCl����0.01mol NaHCO3
������0.01mol Na2CO3��0.01molNa2CO3����0.01molHCl�������0.01molHCl�Ǻ�NaOH������Ӧ���ĵģ�����NaOH�����ʵ���Ҳ��0.01mol������NaOH��Na2CO3���ʵ���֮��Ϊ1:1��
��2������150mL����ʱ����Һ�е�����ֻ��NaCl������ԭ���غ㣬��ȡ����10mL��Ӧ�����Һ�У�n(NaOH)=n(HCl)=0.15L��0.2 mol��L��1=0.03mol������ԭ����������Һ�����ʵ���Ũ��Ϊ![]() =3mol/L��
=3mol/L��
II���������ᡢ����������Һ��Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��2Al+6HCl=2AlCl3+3H2����2Al+2NaOH+2H2O=2NaAlO2+3H2�������������������Һ����������ʵ���Ũ�ȶ���ȣ������ʵ����ʵ�����ȣ���HCl��NaOH��Ϊ6mol��������������ֱ�Ϊ3mol��9mol��ͬ��ͬѹ�����ʵ���֮�ȵ�������ȣ����Բ���H2�����֮����3:9=1:3��
III����һ������Fe��FeO��Fe2O3�Ļ�����м���100 mLŨ��Ϊ2.0 mol��L��1�����ᣨ��HCl�����ʵ���Ϊ0.1L�� 2.0 mol��L��1=0.2mol����ǡ��ʹ�������ȫ�ܽ⣬������Һ�м���KSCN��Һ����Ѫ��ɫ���֣�˵����Һ�е�����ֻ��FeCl2��������Ԫ���غ㣬n(FeCl2)=![]() n(Cl-)=0.1mol������������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ܵõ��������ʵ�����FeCl2�����ʵ�����ȣ���0.1mol����������������0.1mol��56g/mol=5.6g������������ԭ���غ㣨�������غ㣩��
n(Cl-)=0.1mol������������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ܵõ��������ʵ�����FeCl2�����ʵ�����ȣ���0.1mol����������������0.1mol��56g/mol=5.6g������������ԭ���غ㣨�������غ㣩��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����⼼��ԭ����ͼ��ʾ���������з�����ij��ӦaΪC(s)+2H2O(g)![]() CO2(g)+2H2(g)����H�������й�˵����ȷ���ǣ� ��
CO2(g)+2H2(g)����H�������й�˵����ȷ���ǣ� ��
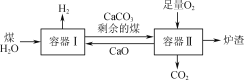
A.��֪��Ӧa��һ���������ܹ��Է����У���÷�Ӧ����H<0
B.���������м���CaO����Чʵ��H2��CO2�ķ���
C.ʣ���ú������������Ϊ�˳����������O2��Ӧ�ų�������
D.ú�к��е�S��������������ת��ΪCaSO3����¯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͼΪһ��������ͼ����С����ͼ���Ϸֱ�д��H2��CO2��Na2O��NaCl��FeCl3�������ʣ�ͼ���������������ʾ��ɹ���Ϊһ�࣬�ཻ����A��B��C��DΪ����Ӧ�ķ������ݴ��š���ش��������⣺
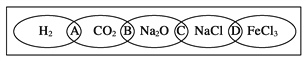
��1���뽫�������ݴ���������Ӧ�������ڣ�
��______���������ʶ����ǵ����
��______���������ʶ�����
��2���ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ��뱥�͵�ͼ��ij������M����Һ�������ʺ��ɫ��
������M�Ļ�ѧʽΪ________________��
��֤���к��ɫ�������ɵ�ʵ�������________________________________________��
����Ӧ��A��2F2��2H2O��4HF��O2���� B��2Na��2H2O��2NaOH��H2����
C��CaO��H2O��Ca(OH)2�� D��2H2O��2H2����O2����
����ˮ������������______��ˮ�ǻ�ԭ������________�����������
(��)��Ӧ��3Cu + 8HNO3 = 3Cu(NO3)2+2NO��+4H2O,��ԭ���������������ʵ���֮�ȣ�_______������0.6mol����ת��ʱ�����ɵ�NO�ڱ�״�������Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵĿ�������������Դ�о���ռ����Ҫ��λ��������̫���ܵ��Ƭ�ڼӹ�ʱ��һ���������ͭ���ܡ����ء����ȡ��ش��������⣺
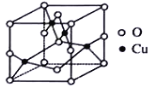
��1����̬����ͭ���ӵĵ����Ų�ʽΪ______����֪������Cu2O��CuO���ȶ����ԴӺ�������Ų��ǶȽ���______��
��2��ͭ��ij�������ᄃ����ͼ���þ����������ӵĸ���Ϊ_________��
��3��ͭ��(SCN)2��Ӧ����Cu(SCN)2��������Ϊ___________��HSCN�ṹ�����֣�������(H��S��C��N)�ķе������������(H��N=C=S)��ԭ����_________��
��4��BF3����NH3��Ӧ����BF3��NH3��B��N֮���γ���λ������ԭ���ṩ_____���ڶ�����Ԫ���У������ܽ���B��N֮���Ԫ����_______����
��5����ͼEMIM+�����У�̼ԭ�ӵ��ӻ���ʽ��___________�������еĴ��������÷�����nm��ʾ������n���������γɴ�������ԭ������m���������γɴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ��66)����EMM+�����еĴ�����Ӧ��ʾΪ___________��
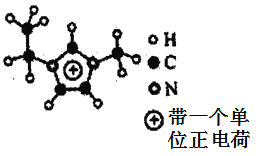
��6����ͼ������������ṹ��ʯī�������ƣ����������������в��������Ϊ___________�������������ڸ��¸�ѹ�£�����ת��Ϊ������������ṹ��Ӳ������ʯ���ƣ��侧����ͼ�������߳�Ϊ361.5pm��������������ܶ���___________g��cm��3(ֻ����ʽ��![]() Ϊ�����ӵ�������ֵ)��
Ϊ�����ӵ�������ֵ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ�����У����뷴Ӧ���Ļ��������NO��O2�����ʵ��������քeΪ0.10��0.06��������ѧ��Ӧ2NO(g)+O2(g) ![]() 2NO2(g)��������������ͬʱ�����ʵ���������±���
2NO2(g)��������������ͬʱ�����ʵ���������±���
ѹǿ/����105Pa�� | �¶�/�� | NO�ﵽ����ת������Ҫʱ��/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
���ݱ������ݣ�����˵����ȷ����
A.�����¶ȣ���Ӧ���ʼӿ�
B.����ѹǿ����Ӧ���ʱ���
C.��1.0��105 Pa��90�������£���ת����Ϊ98%ʱ��Ӧ�Ѵ�ƽ��
D.�����뷴Ӧ���Ļ������Ϊa mol����Ӧ������![]() ��ʾ������8.0��105Pa��30�������£�ת���ʴ�50%����90%ʱ��NO�ķ�Ӧ����Ϊ
��ʾ������8.0��105Pa��30�������£�ת���ʴ�50%����90%ʱ��NO�ķ�Ӧ����Ϊ![]() mols-1
mols-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����(����)
�ٱ�״���£�1LHCl��1LH2O�����ʵ�����ͬ��
�ڳ��³�ѹ�£�1gH2��14gN2�������ͬ��
��28gCO�����Ϊ22.4L��
���������ʵ����ʵ�����ͬ���������ڱ�״���µ����Ҳ��ͬ��
��ͬ��ͬ���ʱ����������ʵ���Խ����ѹǿԽ��
��ͬ��ͬѹ�£�������ܶ����������Է�������������
A. �٢ۢܢ�B. �ڢݢ�C. �ݢ�D. �٢ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����( )
A.����ʯ��ˮ��ϡ���ᷴӦ��Ca(OH)2+2H+=Ca2++2H2O
B.����ͨ�뵽FeCl2��Һ�У�Fe2++Cl2=Fe3++2Cl-
C.ϡ����������������Һ��Ӧ��H++OH-+Ba2++![]() =H2O+BaSO4��
=H2O+BaSO4��
D.̼��������Һ���������ط�Ӧ��HCO3-+OH-=H2O+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ȣ�������緢���Ƚ������ĺ��������У�������Ӧ��2A(g)+B(s) ![]() C(g)+D(g)�����������в��ܱ�����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
C(g)+D(g)�����������в��ܱ�����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A. ���������ܶȲ��� B. ��λʱ��������n molD��ͬʱ����n molC
C. ��������ƽ����Է����������� D. C(g)�����ʵ���Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ���������Ͷ��200 mLϡ�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ���������NaOH��Һ����ı仯��ϵ��ͼ��ʾ��������˵������ȷ���ǣ� ��
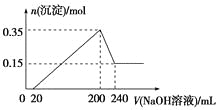
A.þ������������Ϊ9 g
B.�Ͻ���ϡ���ᷴӦ���ɵ��������Ϊ10.08 L
C.ϡ��������ʵ���Ũ��Ϊ2.5 mol/L
D.����������Һ�����ʵ���Ũ��Ϊ5 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com