
【题目】下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氯气通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氢钠溶液与氢氧化钾反应:HCO3-+OH-=H2O+![]()
科目:高中化学 来源: 题型:
【题目】(1)在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为____________________;
②该反应的正反应为__________反应(“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是____________(填字母代号)。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有__________(填序号);常温下0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是 ____________(填离子符号);
②判断Ksp[Mg(OH)2]____________Ksp[Fe(OH)2](填“>”、“=”或“<”)。
(4)电解装置如图所示:
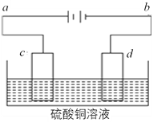
①当用惰性电极电解时,d电极的反应式为____________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集和转化是科学研究中的热点问题。我国科研人员提出了以Ni/Al2O3为催化剂,由 CO2(g)和H2(g)转化为CH4(g)和H2O(g)的反应历程,其示意图如下:
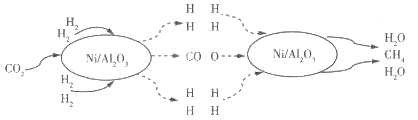
(1)该可逆反应的化学方程式为_________。使用催化剂Ni/Al2O3_________ (填“能”或“不能”)提髙CO2的平衡转化率。
(2)300℃下,在一恒容密闭容器中充入一定量的CO2与H2,发生上述反应,一段时间后反应达平衡,若其他条件不变,温度从300℃升至500℃,反应重新达到平衡时,H2的体积分数增加。下列说法错误的是_________(填标号)。
A.该反应的![]()
B.平衡常数大小:![]()
C.300℃下,减小![]() 的值,
的值,![]() 的平衡转化率升高
的平衡转化率升高
D.反应达到平衡时化![]()
(3)在一定条件下,反应体系中CO2的平衡转化率a( CO2)与L和X的关系如图所示,L和X表示温度或压强。
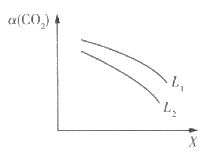
①X表示的物理量是___________。
②L1_____________L2(填“<”“>”),判断理由是______________________________________。
(4)向1 L恒容密闭容器中加入4.0 mol H2(g),1.0 mol CO2,控制条件(催化剂为 Ni/AI2O3、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示。
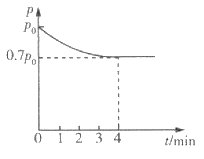
①4 min时CO2的转化率为___________。
②T1温度下该反应的化学平衡常数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取10 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
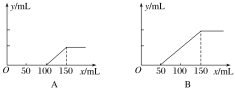
(1)在A情况下,溶质是________________(填化学式),其物质的量之比为________。
(2)原氢氧化钠溶液的物质的量浓度为________________。
II.足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是__________________。
III.向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL浓度为2.0 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL的气体(标准状况),所得溶液中加入KSCN溶液后无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是________,解题依据是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的叙述中,正确的是( )
A. 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. Fe(OH)3胶体微粒能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
D. Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为某学生在实验室中制备高锰酸钾晶体的流程图。
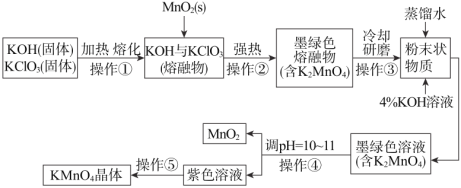
根据上图回答下列问题:
(1)操作①和②均需在坩埚中进行,根据实验实际应选择坩埚为_____(填字母);
a.石英坩埚 b.氧化铝坩埚 c.铁坩埚
(2)已知:3MnO42-+2H2O2MnO4-+MnO2+4OH-。操作④中通CO2调pH=10~11,其目的是_____;
(3)得到墨绿色溶液后,也可用如图所示方法制备KMnO4,电极均为铂电极。
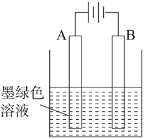
①A极上的电极反应式为_____;
②这种方法与上面的方法相比,其优点是_____;
(4)实验室中,可用0.10mol/L,草酸作标准溶液,利用下述反应,测定所得KMnO4晶体的纯度。5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
取agKMnO4晶体样品配制成100mL溶液。每次取20.00mL于锥形瓶中进行滴定实验两次。两次实验所用草酸标准溶液的体积分别为22.15mL和22.17mL,由此求得KMnO4晶体的纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
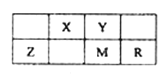
A. 元素的非金属性次序为:Y>X>M
B. 气态氢化物稳定性:M>R
C. Z的氧化物可以做光导纤维
D. 最D高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
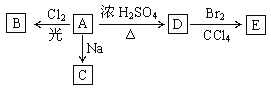
①A分子中的官能团名称是_______。A的同分异构共有_________种(包括A本身)
②A只有一种一氯取代物B。写出由A转化为B的化学方程式:_________________。
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。则F的结构简式是____________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(填序号)_________
① 加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________。
(3)A和“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
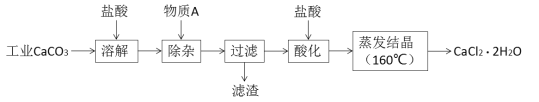
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com