
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
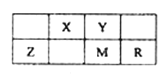
A. 元素的非金属性次序为:Y>X>M
B. 气态氢化物稳定性:M>R
C. Z的氧化物可以做光导纤维
D. 最D高价氧化物对应水化物的酸性:Y>X
科目:高中化学 来源: 题型:
【题目】化合物F是从我国特产植物中提取的一种生物碱,其人工合成路线如图:
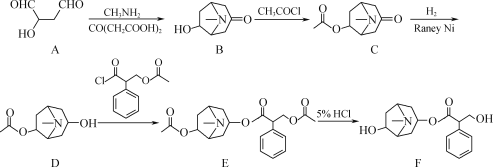
(1)A中含氧官能团的名称为___和___。
(2)C→D的反应类型为___。
(3)E→F的过程中,会有副产物X(分子式为C8H15NO2)生成,写出X的结构简式:___。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__。
①分子中有醚键;
②能与FeCl3溶液发生显色反应,能与盐酸反应;
③有4种不同化学环境的氢且数目比为9∶2∶2∶2。
(5)已知:R—O—R′+2HBr![]() R—Br+R′—Br十H2O(R、R′表示烃基)。
R—Br+R′—Br十H2O(R、R′表示烃基)。
写出以![]() 、CH3NH2和CO(CH2COOH)2为原料制备
、CH3NH2和CO(CH2COOH)2为原料制备![]() 的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分別为0.10和0.06,发生化学反应2NO(g)+O2(g) ![]() 2NO2(g),在其他条件相同时,测得实验数据如下表:
2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在1.0×105 Pa、90℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以![]() 表示,则在8.0×105Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为
表示,则在8.0×105Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为![]() mols-1
mols-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氯气通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氢钠溶液与氢氧化钾反应:HCO3-+OH-=H2O+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是()
A.常温常压下,23 g NO2和N2O4的混合气体一定含有含有NA个氧原子
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个![]()
C.将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA
D.1 mol Cl2与足量的NaOH溶液发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
A. 混合气体的密度不变 B. 单位时间内生成n molD,同时生成n molC
C. 混合气体的平均相对分子质量不变 D. C(g)的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是()
A.Fe2++![]() +Ba2++2OH-=BaSO4↓+Fe(OH)2↓
+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.![]() +Fe2++ 2
+Fe2++ 2![]() + 2Ba2++ 3OH-=2BaSO4↓+ Fe(OH)2↓+ NH3·H2O
+ 2Ba2++ 3OH-=2BaSO4↓+ Fe(OH)2↓+ NH3·H2O
C.2Fe3++ 3![]() + 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3![]() + Fe3++3
+ Fe3++3![]() + 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
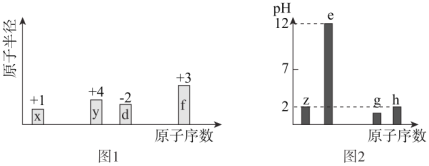
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是______;
(2)比较d、e、f的简单离子半径大小为 < < (用离子符号表示)______;y、h的最高价氧化物对应水化物酸性较强的是______ (用化学式表示);
(3)下列可作为比较c和f金属性强弱的依据是______;
①测同温同压同浓度相应氯化物水溶液的pH
②测两种元素单质的硬度和熔、沸点
③比较单质作还原剂时失去的电子数目的多少
④比较两种元素在化合物中化合价的高低
⑤比较单质与同浓度盐酸反应的难易程度
(4)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者的水溶液均呈碱性,该反应的化学方程式为______。已知eyz含有Z2分子中类似的化学键,写出化合物eyz的电子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com