
【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。
【答案】0.2 c 方法二 方法一产生污染性气体氯气,而方法二产生二氧化碳气体对水体无污染 2 NaClO3 + Na2SO3 + H2SO4 ![]() 2ClO2↑ + 2Na2SO4 + H2O 17 3s23p6 正四面体
2ClO2↑ + 2Na2SO4 + H2O 17 3s23p6 正四面体 ![]() NaCl与 KCl为离子晶体,CCl4为分子晶体,故CCl4的熔点低;K+的半径比Na+的半径大,KCl中离子键强度较NaCl小,故KCl的熔点比NaCl低
NaCl与 KCl为离子晶体,CCl4为分子晶体,故CCl4的熔点低;K+的半径比Na+的半径大,KCl中离子键强度较NaCl小,故KCl的熔点比NaCl低
【解析】
(1)方法一:2NaClO3 + 4HCl →2ClO2↑+ Cl2↑+ 2NaCl + 2H2O,根据化合价变化规律,同种元素化合价不交叉,NaClO3作氧化剂发生还原反应生成ClO2,则两份NaClO3参与反应化合价降低2;四份HCl中2份体现还原性化合价升高生成氯气,化合价升高2,2份HCl中Cl的化合价不变生成氯化钠;则该反应化合价变化为2,转移电子数为2;根据分析电子转移数目与作还原剂的HCl物质的量为1:1,当有0.2 mol电子发生转移时,参与反应的还原剂0.2mol。
(2) 方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O,草酸中的碳元素从+3价→+4价,发生氧化反应做还原剂;故选c;
(3)两种方法相比,方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是方法一产生污染性气体氯气,而方法二产生二氧化碳气体对水体无污染;
(4) 硫酸酸化,Na2SO3做还原剂发生氧化反应得到Na2SO4,化合价升高2,NaClO3发生还原反应生成二氧化氯,化合价降低1,根据化合价守恒n(Na2SO3):n(NaClO3)=1:2,其余部分按照原子守恒配平,故其化学反应方程式为2NaClO3 + Na2SO3 + H2SO4![]() 2ClO2↑ + 2Na2SO4 + H2O;
2ClO2↑ + 2Na2SO4 + H2O;
(5)氯原子核外共有17个电子,每个电子的运动状态都不同,故有17种不同运动状态的电子;按照构造原理氯离子的最外层电子排布式是3s23p6;
(6)CCl4中C的价层电子对数为4,没有孤电子对,则CCl4分子的空间构型为正四面体; CO2的电子式是![]() ;
;
(7)对比物质的熔沸点,首先确定物质的晶体类别,一般熔沸点大小比较:原子晶体>离子晶体>分子晶体;若均为离子晶体,比较离子键强弱; NaCl与 KCl为离子晶体,CCl4为分子晶体,故CCl4的熔点低;K+的半径比Na+的半径大,KCl中离子键强度较NaCl小,故KCl的熔点比NaCl低。


科目:高中化学 来源: 题型:
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
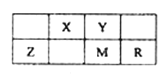
A. 元素的非金属性次序为:Y>X>M
B. 气态氢化物稳定性:M>R
C. Z的氧化物可以做光导纤维
D. 最D高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其他测量值偏低的是( )
①用稀醋酸和稀氢氧化钠溶液反应测定中和热数值;②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④在用标准液(已知浓度)滴定未知溶液时,盛标准液的滴定管水洗后未润洗;⑤定容时,仰视容量瓶的刻度线
A. ①③⑤B. ①②⑤
C. ②③④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
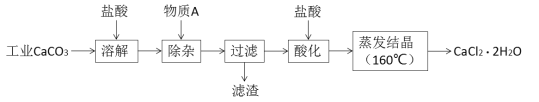
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从粉煤灰(含莫来石、石英等)中回收![]() 的一种工艺流程如下:
的一种工艺流程如下:
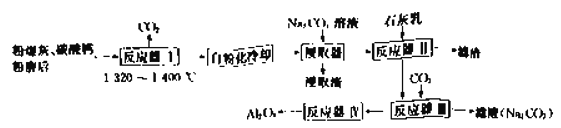
(1)经反应器I可使莫来石和石英转化为![]() (硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的
(硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的![]() 得到活化。
得到活化。
(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是_______。
(3)浸取器中,适量增大![]() 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为![]() 的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
(4)反应器Ⅲ中发生反应的离子方程式为:__________________________________。
(5)反应器Ⅳ采取工艺方法是_____________________;上述工艺流程中可以循环使用的物质是_______________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
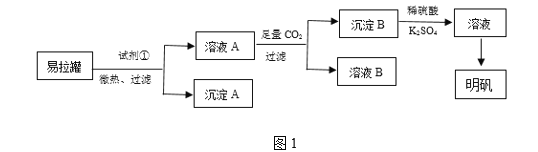
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com