
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
【答案】②⑤ ①⑥ ②⑦ ①③⑥⑦ NaOH和Na2CO3 NaHCO3和Na2CO3 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 电中性 小于
Fe(OH)3(胶体)+3HCl 电中性 小于
【解析】
(1)在水溶液中或熔融状态下能够导电的化合物为电解质;
(2)离子反应体现的是强酸与强碱反应生成水的过程;
(3)该物质与酸、碱均反应;
(4)有自由移动的离子或电子的物质能导电;
(5)④与⑥充分反应后,根据二氧化碳的用量分情况讨论;
(6)实验室用饱和FeCl3溶液滴入沸水中加热制备氢氧化铁胶体,胶体不带电,得到的胶体微粒是多个氢氧化铁的聚集体,据此分析作答;
(1)根据定义可知,①③⑥⑦虽能导电,但属于混合物,不属于电解质;④虽为化合物,但在水溶液中不是本身电离出自由移动的阴阳离子,所以不属于电解质;②和⑤属于盐,在水溶液中或熔融状态下能够导电,属于电解质,
故答案为:②⑤;
(2)离子方程式为:H++OH-=H2O,说明是强酸和强碱的中和反应,上述物质中,①稀硫酸与⑥稀氢氧化钠的反应符合该离子方程式,
故答案为:①⑥;
(3)②小苏打是NaHCO3的俗名,它可与H+反应生成水和二氧化碳,同时可以与OH-反应生成碳酸根离子与水;⑦硝酸亚铁溶液其溶质Fe(NO3)2遇NaOH会生成氢氧化亚铁沉淀与水,当加入盐酸时,因溶液中的硝酸根离子与氢离子结合会具有强氧化性,所以Fe2+会与H+和NO3-发生氧化还原反应,故符合题意的有:②⑦,
故答案为:②⑦;
(4)上述物质中,溶液有自由移动的阴阳离子,所以导电的物质为:①③⑥⑦,
故答案为:①③⑥⑦;
(5)二氧化碳与NaOH充分反应,①若CO2少量,则发生的反应为:CO2+2NaOH(过量) = Na2CO3+H2O,则溶液中溶质为NaOH和Na2CO3,水分蒸干后,得到的固体组成成分为:NaOH和Na2CO3;②CO2过量,则过量的CO2继续与生成的Na2CO3,其化学方程式为:CO2+ Na2CO3 + H2O = 2 NaHCO3,其固体组成成分可能是:NaHCO3和Na2CO3,
故答案为:NaOH和Na2CO3、NaHCO3和Na2CO3;
(6)实验室制备Fe(OH)3胶体的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,
Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;得到的胶体不带电,即电中性;一个氢氧化铁胶粒是多个氢氧化铁的聚集体,所以1 mol FeCl3形成的胶体个数小于NA个,
Fe(OH)3(胶体)+3HCl;得到的胶体不带电,即电中性;一个氢氧化铁胶粒是多个氢氧化铁的聚集体,所以1 mol FeCl3形成的胶体个数小于NA个,
故答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;电中性;小于。
Fe(OH)3(胶体)+3HCl;电中性;小于。


科目:高中化学 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。
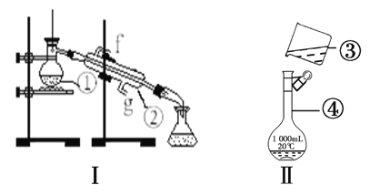
(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可以用于NH3、SO2等气体的制备。

请回答下列问题:
(1)若用Ca(OH)2固体和NH4Cl固体制取少量NH3,则选用的装置是_____(填序号)产生NH3的化学方程式为__________________________________,干燥NH3可以用____________(试剂名称),检验集气瓶中是否收集满氨气的方法是____________________________________。
(2)若用铜与浓硫酸反应制取SO2,应选用装置________(填序号),产生SO2的化学方程式为_____________________________________________________。(填序号)
下列溶液能直接用于检验SO2气体存在的是__________。
A.酸性KMnO4溶液 B.NaOH溶液 C.Na2CO3溶液 D.品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
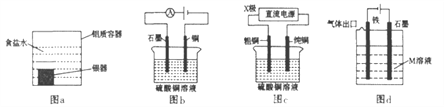
A. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
B. 图c中的X极若为负极,则该装置可实现粗铜的精炼
C. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
D. 利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-= 2Ag+S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图,关于该有机物的空间构型下列说法中正确的是( )
![]()
A. 该分子中一定共面的碳原子数至少为8个
B. 该分子中所有的碳原子均可能处于同一平面上
C. 该分子中至少有9个碳原子处于同一条直线上
D. 该分子中处于同一平面的的原子总数最多为16个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
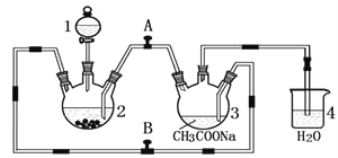
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com