
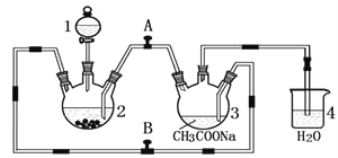
【题目】醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
【答案】 分液漏斗 C 让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化 B A 过量的锌与CrCl3充分反应得到CrCl2 83.3% 空气或氧气 5.6
【解析】(1)根据仪器结构特征,可知仪器1为分液漏斗;(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,答案选C;目的是:让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A;(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2;(5)CrCl3为![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol×
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol×![]() ×376g/mol=11.28g,所得产品的产率为
×376g/mol=11.28g,所得产品的产率为![]() × 100% = 83.3%;(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,溶液pH=-lgc(H+)=5.6。
× 100% = 83.3%;(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,溶液pH=-lgc(H+)=5.6。


科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料可以合成药物SERMs的中间体E。其合成路线如下:

回答下列问题:
(1)A的化学名称为_________;E中官能团的名称为________________。
(2)A~B的反应类型为________,B→C的反应类型为________________。
(3)B的结构简式为_________________。
(4)由D生成E的化学方程式为__________________。
(5)二取代芳香族化合物W是E的同分异构体,符合下列条件的W共有___种(不含立体异构)。
①1molW能与足量银氨溶液发生银镜反应生成4molAg
②能与FeCl3溶液发生显色反应
其中核磁共振氢谱为六组峰的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
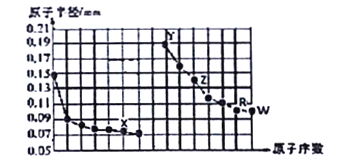
A. X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
B. R简单氢化物的酸性弱于W简单氢化物,故元素非金属性R小于W
C. 在同周期中,W的含氧酸酸性最强
D. 已知Z的一种金属储氢材料LiZH4(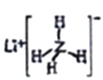 )遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
)遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )

A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关:“四中子”微粒的说法正确的( )
A.该微粒的质量数为2
B.该微粒不显电性
C.它与普通中子互称为同位素
D.在元素周期表中与氢元素占同一位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子的能量较高
C.P,S,Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
①CuCl2 ②FeCl2 ③MgCl2 ④ZnCl2
A.③④B.②③C.②③④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com