
【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
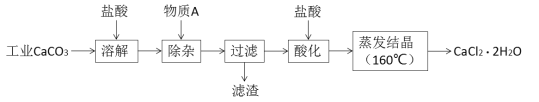
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。
【答案】5.2≤pH<7.8 Ca(OH)2 或CaO或CaCO3 取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全 将溶液中的少量Ca(OH)2转化为CaCl2 烧杯、玻璃棒、胶头滴管、滴定管 99.9% 蒸发结晶过程中,温度过高,使CaCl2·2H2O失去部分结晶水
【解析】
工业碳酸钙加过量盐酸进行溶解,得到Ca2+、Al3+、Fe3+,加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据沉淀对应的pH表,需要把二者沉淀完全,pH最小为5.2,但是当pH大于等于7.8,氢氧化铝开始溶解,故调节pH范围是5.2≤pH<7.8;加入的A能调节pH,但是不能引入新杂质,则可以选用Ca(OH)2 或CaO或CaCO3;过滤后滤液进行盐酸酸化,在160℃蒸发结晶,得产品CaCl2·2H2O。
(1)根据分析,加入物质A来调节溶液的pH,此时控制溶液的pH范围是5.2≤pH<7.8;加入的物质A是Ca(OH)2 或CaO或CaCO3(填一种即可);
(2)检验Fe3+是否沉淀完全的实验操作是:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全;
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是将溶液中的少量Ca(OH)2转化为CaCl2,防止产物中混有Ca(OH)2杂质;
(4) ①测定样品的纯度过程中,a为配制一定体积物质的量浓度溶液的过程,需要用到的玻璃仪器:烧杯、玻璃棒、250mL容量瓶、胶头滴管;b、c为滴定过程,需要用到的玻璃仪器:锥形瓶、滴定管;故上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有烧杯、玻璃棒、胶头滴管、滴定管;②使用AgNO3溶液滴定样品的CaCl2·2H2O,n(Ag+)=0.050 mol/L×20.39 ×10-3L=1.0195 ×10-3mol,则25mL中含n(Cl-)=1.0195×10-3mol,250 mL中含n(Cl-)=1.0195×10-2mol,含n(CaCl2·2H2O)=5.0975×10-3mol,m(CaCl2·2H2O)=5.0975×10-3mol×147g·mol-1=0.7493g,样品CaCl2·2H2O的质量分数=![]() =99.9%;③蒸发结晶过程中,温度过高,使CaCl2·2H2O失去部分结晶水,而计算的时候仍按照没有失去结晶水的化合物质量计算,故最终测定的样品中CaCl2·2H2O的质量分数偏高。
=99.9%;③蒸发结晶过程中,温度过高,使CaCl2·2H2O失去部分结晶水,而计算的时候仍按照没有失去结晶水的化合物质量计算,故最终测定的样品中CaCl2·2H2O的质量分数偏高。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氯气通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氢钠溶液与氢氧化钾反应:HCO3-+OH-=H2O+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
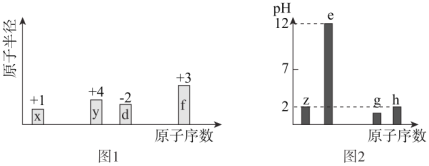
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是______;
(2)比较d、e、f的简单离子半径大小为 < < (用离子符号表示)______;y、h的最高价氧化物对应水化物酸性较强的是______ (用化学式表示);
(3)下列可作为比较c和f金属性强弱的依据是______;
①测同温同压同浓度相应氯化物水溶液的pH
②测两种元素单质的硬度和熔、沸点
③比较单质作还原剂时失去的电子数目的多少
④比较两种元素在化合物中化合价的高低
⑤比较单质与同浓度盐酸反应的难易程度
(4)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者的水溶液均呈碱性,该反应的化学方程式为______。已知eyz含有Z2分子中类似的化学键,写出化合物eyz的电子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是( )
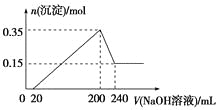
A.镁和铝的总质量为9 g
B.合金与稀硫酸反应生成的氢气体积为10.08 L
C.稀硫酸的物质的量浓度为2.5 mol/L
D.氢氧化钠溶液的物质的量浓度为5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
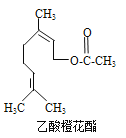
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③B. ①②⑤C. ①②⑤⑥D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com