
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
【答案】3.36L 1∶2 < 15 1.5 24.5L/mol 0.15mol/L 6:3:2 16.8g/mol 80% 125a/9V Al3++3HCO3-===Al(OH)3↓+3CO2↑ 3Fe+4H2O(g)![]() Fe3O4+4H2 CN-+S2O32-===SCN-+SO32- Cr2O72-+3NO2-+8H+===2Cr3++3NO3-+4H2O Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O
Fe3O4+4H2 CN-+S2O32-===SCN-+SO32- Cr2O72-+3NO2-+8H+===2Cr3++3NO3-+4H2O Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O
【解析】
Ⅰ由公式n=![]() =
=![]() =
=![]() cV进行运算,结合电荷守恒、原子守恒等计算技巧可得;
cV进行运算,结合电荷守恒、原子守恒等计算技巧可得;
Ⅱ. (1)碳酸氢钠和硫酸铝水解相互促进生成CO2;
(2)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(3)CN-与S2O32-反应生成SCN-和SO32-;
(4)根据得失电子守恒、原子守恒、电荷守恒可写;
(5)Ba(OH)2溶液与NaHSO4溶液的反应后呈中性,说明生成物是硫酸钡、硫酸钠和水。
Ⅰ(1)n(NH3)=![]() =0.1mol,n(H)=0.3mol,则含有的氢原子数相同的H2S物质的量为0.15mol,标准状况下,0.15mol H2S气体占有的体积是3.36L;
=0.1mol,n(H)=0.3mol,则含有的氢原子数相同的H2S物质的量为0.15mol,标准状况下,0.15mol H2S气体占有的体积是3.36L;
(2)2 mol CO2的原子数为6NA,3 mol SO3的原子数为12NA,则2 mol CO2与3 molSO3的原子数之比是1∶2;
(3)常温常压下,气体摩尔体积大于22.4L/mol,22.4L CO2中分子个数小于NA,
64克SO2的分子个数为NA,常温常压下22.4升CO2中分子个数<64克SO2的分子个数;
(4)标准状况下,n(NH3)=![]() =1.5mol,所含电子的物质的量约为1.5mol
=1.5mol,所含电子的物质的量约为1.5mol ![]() 15mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为
15mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为![]() =1.5mol/L;
=1.5mol/L;
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为![]() =24.5L/mol;
=24.5L/mol;
(6)由电荷守恒:c(Na+)+ 2c(Mg2+)= c(Cl﹣)+ 2c(SO42﹣)代入数值得0.2molL﹣1+ 2![]() 0.25molL﹣1= 0.4molL﹣1+ 2c(SO42﹣),则c(SO42﹣)=0.15mol/L;
0.25molL﹣1= 0.4molL﹣1+ 2c(SO42﹣),则c(SO42﹣)=0.15mol/L;
(7)分别与足量的AgNO3溶液反应,生成沉淀的质量相等,则n(Cl﹣)相等。设AgCl为1mol,根据氯离子守恒,则n(NaCl)=1mol、n(CaCl2)=0.5mol,n(AlCl![]() mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:
mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:![]() mol=6:3:2,等体积的NaCl、CaCl2、AlCl3三种溶液,三种溶液中所含溶质的物质的量浓度之比= NaCl、CaCl2、AlCl3的物质的量之比=6:3:2;
mol=6:3:2,等体积的NaCl、CaCl2、AlCl3三种溶液,三种溶液中所含溶质的物质的量浓度之比= NaCl、CaCl2、AlCl3的物质的量之比=6:3:2;
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量=0.75g/L![]() L/mol=16.8 g/mol。设NH3的体积分数为x,则甲烷体积分数为(1-x),则17x+16(1-x)=16.8,解得x=0.8,即NH3的体积分数为80%;
L/mol=16.8 g/mol。设NH3的体积分数为x,则甲烷体积分数为(1-x),则17x+16(1-x)=16.8,解得x=0.8,即NH3的体积分数为80%;
(9)含Al3+ ag,n(Al3+)=![]() mol,n(SO42-)=
mol,n(SO42-)=![]() mol。VmLAl2(SO4)3溶液中,取0.5VmL溶液,取出的n(SO42-)=
mol。VmLAl2(SO4)3溶液中,取0.5VmL溶液,取出的n(SO42-)=![]() mol,稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度=
mol,稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度=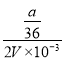 mol/L=125a/9V mol/L;
mol/L=125a/9V mol/L;
Ⅱ. (1)(1)碳酸氢钠和硫酸铝水解相互促进,生成CO2可灭火,泡沫灭火器反应原理的离子方程式为3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,该离子为SCN-;另一种与H+作用产生能使品红溶液褪色的刺激性气体,该气体为二氧化硫,生成的另一种离子为SO32-,该反应的离子反应方程式为:CN-+S2O32-=SCN-+SO32-;
(4)反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,NO2-→NO3-,N元素由平均化合价+3价升高为+5价,共升高2价,化合价最小公倍数为6,Cr2O72-的系数为1,NO2-的系数为3,再根据原子守恒、电荷守恒配平其它物质系数,配平后的方程式为Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O;
(5)Ba(OH)2溶液与NaHSO4溶液的反应后呈中性,说明生成物是硫酸钡、硫酸钠和水,离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。


科目:高中化学 来源: 题型:
【题目】常温下,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是

A. W点所示的溶液中:c(Na+)>c(CO32-)= c(HCO3-)>c(OH-)>c(H+)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+ c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. pH=11的溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
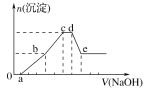
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
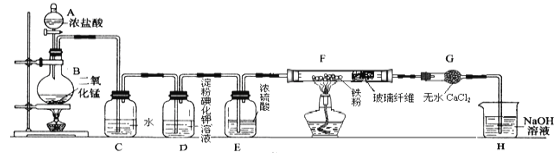
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
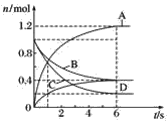
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH 是一种无色有刺激性气味的液体,在生产生活中有重要用途。
Ⅰ.目前工业上有一种方法是用 CO2 生产燃料甲醇。一定条件下发生反应:CO2(g) +3H2(g)=CH3OH(g)+H2O(g),该反应的能量变化如图所示:
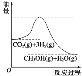
(1)你认为该反应为_____(填放热或吸热)反应.
(2)恒容容器中,对于以上反应,能加快反应速率的是_____。
a.升高温度 b.充入 He c.加入催化剂 d.降低压强
Ⅱ. CH3OH 也是一种重要的燃料,一定条件下发生反应:
2CH3OH(g)+3O2(g) =2 CO2(g)+4H2O(g)。
(3)某温度下,将 4mol CH3OH 和 6 mol O2 充入 2 L 的密闭容器中经过 4 min 反应达到平衡,测得 c(O2)=1.5mol·L-1,4 min 内平均反应速率 υ(H2O)=_____。
(4)CH3OH 燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是_____(填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗 6.4 g CH3OH 转移 1.2 mol 电子
(5)以 CH3OH、空气(氧气)、氢氧化钾溶液为原料,石墨为电极构成燃料电池,该电池中负极上的电极反应式是:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的电子排布式为____,碳、氮、氧元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)NH4Cl中阳离子的空间构型为______,与NH4+互为等电子体的一种非极性分子的化学式为________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为_______(配位键用→表示)。
(4)GaAs与GaN均为原子晶体,GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为_________。
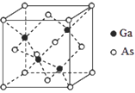
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_______。已知GaAs的密度为ρ g/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,阿伏伽德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为_______pm(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+ = AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C. 苯酚钠溶液通入少量CO2:![]()
D. 实验室用液溴和苯在催化剂作用下制溴苯: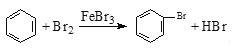
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com