
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置示意图如图所示。下列有关该原电池的说法正确的是

A. 锌片是正极
B. 溶液中H+由铜电极移向锌电极
C. 铜片上有气泡产生
D. 电子由铜电极经导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品是化学学习的基本要求。试回答以下问题:
(1)温度计、量筒、滴定管的一部分如图所示,下列读数(虚线所指刻度)及说法正确的是________(填字母代号)。
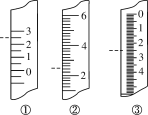
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.①是温度计,读数为2.5 ℃
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有________(填字母代号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管f.碱式滴定管
(3)实验室常见的几种气体发生装置如图A、B、C所示:
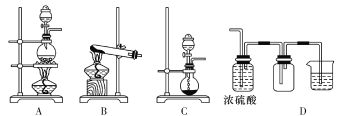
检查装置C气密性的操作方法是________________________。 若用装置A与装置D相连制取、收集气体X,则X可能是下列气体中的________(填数字序号)。
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )

A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强。已知b > 3a,且燃烧后气体体积缩小了b/16mL,则乙烯的体积为( )
A.b/16mL B.b/8mL C.(a- b/8) mL D.(a+ b/8) mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
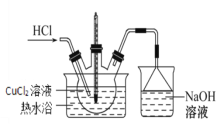
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U的氧化物是第三周期元素形成的常见两性氧化物;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是_______ (用元素符号表示,下同)。三种元素的第一电离能由大到小的顺序为__________。
(2)写出Y的价电子排布式____,W同周期的元素中,与W原子最外层电子数相等的元素还有________。
(3)根据等电子体原理,可知化合物XZ的结构式是________, YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________ (用化学式表示),原因是_____________。
(5)Y的氢化物易液化的原因是___________。
(6)XZ32-的立体构型是________,其中X原子的杂化轨道类型是________,互为等电子体的离子________。
(7)用氢键表示式写出Z的氢化物中存在的氢键________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com