
【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
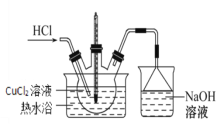
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。
【答案】将Fe2+完全氧化成Fe3+ beceda 抑制Cu2+水解,增大Cl-浓度,有利于CuCl2·2H2O结晶 26~42℃ B 2Cu2++4I-=2CuI↓+I2 85.50%
【解析】
CuO(FeO)与HCl反应产生CuCl2、FeCl2,然后向反应后的溶液中加入H2O2,FeCl2被氧化产生FeCl3,然后调节溶液的pH至2.8<pH<5.2,使Fe3+形成Fe(OH)3沉淀,然后过滤,得到CuCl2溶液,将溶液蒸发浓缩,调整水温至26~42℃得到CuCl2·2H2O,然后在HCl气氛中加热得到无水CuCl2。
(1)步骤II加入稍过量的双氧水的目的是发生反应:2Fe2++H2O2+2H+=2Fe3++2H2O,使Fe2+完全被氧化成Fe3+。
(2)步骤III,需要用到下列所有的操作,首先调pH=3.0,使Fe3+形成Fe(OH)3沉淀,然后将其过滤除去,再调pH=7.0,使Cu2+形成Cu(OH)2沉淀,再过滤,得到Cu(OH)2沉淀,然后洗涤,除去Cu(OH)2沉淀表面的杂质,用稀盐酸溶解,就得到纯净的CuCl2溶液,故合理顺序是beceda。
(3)①在步骤IV中持续通入HCl的作用是抑制Cu2+水解,增大Cl-浓度,有利于CuCl2·2H2O结晶;
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在至26~42℃时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在至26~42℃时析出晶体,抽滤,洗涤,干燥。
③A.溶液显强酸性,会腐蚀滤纸,因此抽滤时,需用玻璃纤维替代滤纸,A正确;
B.洗涤晶体时不要关闭水龙头,应用蒸馏水缓慢淋洗沉淀,抽滤后关闭水龙头,B错误;
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,以防止倒吸现象的发生,C正确;
D.由于结晶水合物在温度较高时会失去结晶水,发生水解反应,为防止变质,得到纯净的CuCl2·2H2O晶体宜采用低温干燥,D正确;
故合理选项是B。
(4)①CuCl2与过量的KI发生氧化还原反应,产生CuI、I2、KCl,反应的离子方程式为:2Cu2++4I-=2CuI↓+I2;
②根据反应方程式2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O62-+2I-可得关系式:2Cu2+~I2~2S2O32-,n(Na2S2O3)=0.1000mol/L×0.02L=0.00200mol,则n(Cu2+)=0.00200mol,根据Cu元素守恒,可得m(CuCl2·2H2O)=0.00200mol×171g/mol=0.3420g,所以该样品中CuCl2·2H2O的质量分数为(0.3420g÷0.4000g)×100%=85.50%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+ = AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C. 苯酚钠溶液通入少量CO2:![]()
D. 实验室用液溴和苯在催化剂作用下制溴苯: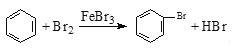
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____(填标号)。

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;⑩NaOH
;⑩NaOH
(1)这些物质中,属于共价化合物的是______![]() 填序号,下同
填序号,下同![]() ;只含有离子键的是______;不含化学键的是______。
;只含有离子键的是______;不含化学键的是______。
(2)写出下列物质的结构式![]() ______;
______;![]() ______。
______。
(3)写出下列物质的电子式![]() ______;⑩NaOH______。
______;⑩NaOH______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W原子最外层电子数是其内层电子数的3倍。下列说法错误的是
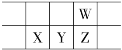
A.原子半径:W<X
B.Y 的最高价氧化物的水化物是强酸
C.气态氢化物热稳定性:Z<W
D.X 的位置为第三周期IVA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH2(g)中的H-H键需要吸收436kJ能量,断裂1molI2(g)中的I-I键需要吸收151kJ能量,生成HI(g)中的1molH-I键能放出299kJ能量。下列说法正确的是
A.1molH2(g)和1molI2(g)的总能量为587kJ
B.H2(g)+I2(s)![]() 2HI(g)ΔH=-11kJ·molˉ1
2HI(g)ΔH=-11kJ·molˉ1
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)ΔH=+5.5kJ·molˉ1
I2(g)ΔH=+5.5kJ·molˉ1
D.H-H键比I-I键更容易断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃X在标准状况下的密度为1.16g·L-1,A能发生银镜反应,E具有水果香味,有关物质的转化关系。
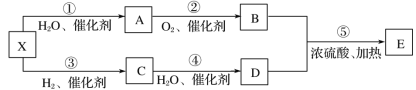
请回答:
(1)C中含有的官能团名称是_________。
(2)化合物M是A的同系物,比A少一个碳原子,请写出M的结构式_________。
(3)下列说法正确的是_________(填字母)。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物C分子中的所有原子在同一平面上
C.反应③为还原反应,反应④为氧化反应
D.有机物B、D、E均能与NaOH反应
(4)化合物E广泛用于药物、染料、香料等工业,实验室常用如图装置来制备E。装置中,溶液M为_________。反应结束后,将试管中收集到的产品倒入_________中,振荡、静置,然后_________(填操作)分离溶液M。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com