
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W原子最外层电子数是其内层电子数的3倍。下列说法错误的是
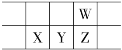
A.原子半径:W<X
B.Y 的最高价氧化物的水化物是强酸
C.气态氢化物热稳定性:Z<W
D.X 的位置为第三周期IVA族
【答案】B
【解析】
W、X、Y、Z为短周期主族元素,根据图示可知,W位于第二周期,X、Y、Z位于第三周期,W原子最外层电子数是其内层电子数的3倍,则W核外电子排布是2、6,则W是O元素,根据元素在周期表的相对位置可知X为Si,Y为P,Z为S元素,据此解答。
根据分析可知:W为O,X为Si,Y为P,Z为S元素。
A.原子核外电子层越多原子半径越大,则原子半径W<X,A正确;
B.Y是 P,Y 的最高价氧化物的水化物H3PO4是中强酸,属于弱酸,B错误;
C.元素的非金属性Z<W,则气态氢化物热稳定性:Z(S)<W(O),C正确;
D.X是Si元素,原子核外电子排布是2、8、4,所以X 的位置为第三周期IVA族,D正确;
故合理选项是B。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强。已知b > 3a,且燃烧后气体体积缩小了b/16mL,则乙烯的体积为( )
A.b/16mL B.b/8mL C.(a- b/8) mL D.(a+ b/8) mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(1)硫原子的价层电子排布图为_____,烟花燃放过程中,钾元素中的电子跃迁的方式是____,K、S、N、O四种元素第一电离能由大到小的顺序为____。上述反应涉及的元素中电负性最大的是_____(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为______,CO2分子的立体构型为_____。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______。
③CO分子中π键与σ键个数比为______。
(3)超氧化钾的晶胞结构图如下,则与K+等距离且最近的O2 - 个数为_____,若晶胞参数为dpm,则该超氧化物的密度为___g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
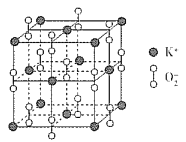
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
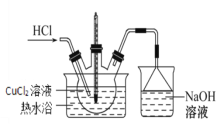
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,100mL0.1mol·L-1 的H2A 溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
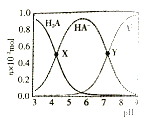
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.X 点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+) +c(Na+)=c(OH-)+3c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
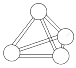
A. N4分子属于一种新型的化合物B. N4分子中只含有非极性键
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、H2SO4、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HF、NH3、CH3OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子一定不是非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com