
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下所示(部分反应条件及产物略去):
![]()
![]()
![]()
![]()
![]()
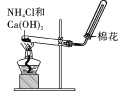
(1)若A是一种淡黄色固体单质,则C与H2O反应的生成物为______(填化学式)。
(2)若C是一种淡黄色固体化合物,则C与CO2反应的化学方程式______________________________。
(3)若A可由图所示装置制得,且B、C均为会污染空气的气体,请写出A转化成B的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____(填标号)。

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W原子最外层电子数是其内层电子数的3倍。下列说法错误的是
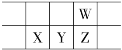
A.原子半径:W<X
B.Y 的最高价氧化物的水化物是强酸
C.气态氢化物热稳定性:Z<W
D.X 的位置为第三周期IVA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH2(g)中的H-H键需要吸收436kJ能量,断裂1molI2(g)中的I-I键需要吸收151kJ能量,生成HI(g)中的1molH-I键能放出299kJ能量。下列说法正确的是
A.1molH2(g)和1molI2(g)的总能量为587kJ
B.H2(g)+I2(s)![]() 2HI(g)ΔH=-11kJ·molˉ1
2HI(g)ΔH=-11kJ·molˉ1
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)ΔH=+5.5kJ·molˉ1
I2(g)ΔH=+5.5kJ·molˉ1
D.H-H键比I-I键更容易断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X仅由三种短周期元素组成,X隔绝空气加热,可分解为盐A和气体B,有关该反应的物质转换、现象和量的关系如下图所示。

(1)检验盐A中阳离子的方法及现象是____________。
(2)请用双桥法分析并表达化合物X分解时,电子转移的方向和数目____________。
(3)白色沉淀C在紫外光照射下会发生分解,请写出该反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃X在标准状况下的密度为1.16g·L-1,A能发生银镜反应,E具有水果香味,有关物质的转化关系。
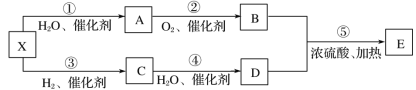
请回答:
(1)C中含有的官能团名称是_________。
(2)化合物M是A的同系物,比A少一个碳原子,请写出M的结构式_________。
(3)下列说法正确的是_________(填字母)。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物C分子中的所有原子在同一平面上
C.反应③为还原反应,反应④为氧化反应
D.有机物B、D、E均能与NaOH反应
(4)化合物E广泛用于药物、染料、香料等工业,实验室常用如图装置来制备E。装置中,溶液M为_________。反应结束后,将试管中收集到的产品倒入_________中,振荡、静置,然后_________(填操作)分离溶液M。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:______________________。
(2)写出下列物质的电子式: D元素形成的单质__________;E2B________________;A、B、E形成的化合物__________;D、E形成的化合物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com