
����Ŀ����֪����1molH2(g)�е�H��H����Ҫ����436kJ����������1molI2(g)�е�I��I����Ҫ����151kJ����������HI(g)�е�1molH��I���ܷų�299kJ����������˵����ȷ����
A.1molH2(g)��1molI2(g)��������Ϊ587kJ
B.H2(g)��I2(s)![]() 2HI(g)��H����11kJ��mol��1
2HI(g)��H����11kJ��mol��1
C.HI(g)![]()
![]() H2(g)��
H2(g)��![]() I2(g)��H��+5.5kJ��mol��1
I2(g)��H��+5.5kJ��mol��1
D.H��H����I��I����������
���𰸡�C
��������
A. ���������ɻ����1mol��ѧ���ͷŻ����յ��������������ʾ��е���������A����
B. H2(g)��I2(g)![]() 2HI(g) ��H��436kJ+151kJ��299kJ��2= -11kJ��mol��1��I2(g)����������I2(s)������H2(g)��I2(s)
2HI(g) ��H��436kJ+151kJ��299kJ��2= -11kJ��mol��1��I2(g)����������I2(s)������H2(g)��I2(s)![]() 2HI(g)��H>��11kJ��mol��1����B����
2HI(g)��H>��11kJ��mol��1����B����
C. H2(g)��I2(g)![]() 2HI(g) ��H��436kJ+151kJ��299kJ��2=- 11kJ��mol��1������ HI(g)
2HI(g) ��H��436kJ+151kJ��299kJ��2=- 11kJ��mol��1������ HI(g)![]()
![]() H2(g)��
H2(g)��![]() I2(g)��H��+5.5kJ��mol��1����C��ȷ��
I2(g)��H��+5.5kJ��mol��1����C��ȷ��
D. H��H���ļ��ܴ���I��I��������I��I���������ѣ���D����
ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ���װ��ʾ��ͼ��ͼ��ʾ�������йظ�ԭ��ص�˵����ȷ����

A. пƬ������
B. ��Һ��H����ͭ�缫����п�缫
C. ͭƬ�������ݲ���
D. ������ͭ�缫����������п�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������࣬����β����Ⱦ�ѳ�Ϊͻ���Ļ�������֮һ����Ӧ��2NO(g)��2CO(g) ![]() 2CO2(g)��N2(g)�����ھ�������β������֪�÷�Ӧ���ʼ�����570 Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ���� (���� )
2CO2(g)��N2(g)�����ھ�������β������֪�÷�Ӧ���ʼ�����570 Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ���� (���� )
A.���β���������ʵij��÷����ǽ����¶�
B.���β���������ʵ����;�������Ƹ�Ч����
C.װ��β������װ�õ������ų��������в��ٺ���NO��CO
D.570 Kʱ��ʱ����CO2��N2��ƽ�ⳣ����������β������Ч�ʸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ô�CuO(��������FeO)�Ʊ��Ȼ�ͭ����(CuCl2��2H2O)����һ���ⶨ���ȣ������������£�

�����Ϣ���£�
���Ȼ�ͭ��ˮ��Һ�нᾧʱ����15�����µõ���ˮ���15��25.7��õ���ˮ���26��42��õ���ˮ���42�����ϵõ�һˮ���100��õ���ˮ�
�ڽ��������γ��������������pH��Χ��
�������� | pH | |
��ʼ���� | ��ȫ���� | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)����II�����Թ�����˫��ˮ��Ŀ����___��
(2)����III����Ҫ�õ����������IJ�����
a.�������ܽ� b.��pH=3.0 c.��pH=7.0 d.ϴ�� e.���ˡ�
�����������������ȷ˳��________(�������ظ�ʹ��)��
(3)����IV��װ��ͼ��ͼ��
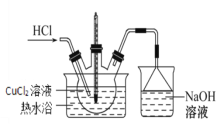
�ٳ���ͨ��HCl��������________��
�ڼ�������Ũ��������Һ������ٵ�ԭ����![]() ʱ������ˮԡ�¶ȿ�����_______ʱ�������壬���ˣ�ϴ�ӣ����
ʱ������ˮԡ�¶ȿ�����_______ʱ�������壬���ˣ�ϴ�ӣ����
�۹�������������˵������������________��
A.����ʱ�����ò�����ά�����ֽ
B.ϴ�Ӿ���ʱӦ�ȹر�ˮ��ͷ���ټ���ϴ�Ӽ�
C.�������ʱ���Ͽ�ˮ�ú�����ƿ֮����ܣ��ٹر�ˮ��ͷ
D.Ϊ�õ�������CuCl2��2H2O�����˲��õ��¸���
(4)������ӵ��������ⶨCuCl2��2H2O��Ʒ�Ĵ��ȣ��������£�ȡ0.4000g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫCuI���������뼸�ε�����Һ��ָʾ������0.1000mol��L-1Na2S2O3 ����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00mL��(�ζ���ӦΪI2+2S2O32-=S4O62-+2I-)
��д�����ɰ�ɫCuI���������ӷ���ʽ________��
�ڸ���Ʒ��CuCl2��2H2O����������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ���һ���������

A.ͼ�ױ�ʾø����Ӧ�ķ�Ӧ�����淴Ӧ�¶ȵı仯
B.ͼ�ұ�ʾ��Ba(OH)2��Һ�еμ�ϡ�����������Ĺ�������Һ�����Եı仯
C.ͼ����ʾ��0.1000mol��L-1NaOH��Һ�ζ�20.00mL0.1000mol��L-1 ����ĵζ�����
D.ͼ����ʾ��ͬ�¶��£�������pH��10������������Һ�Ͱ�ˮ�зֱ��ˮϡ��ʱpH�ı仯���ߣ�����a��ʾ��ˮϡ��ʱpH�ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ����ȷ����
A.��ҵ����Ư�۵Ļ�ѧ����ʽ��2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.�Ʊ��������Ļ�ѧ����ʽ��![]() ��HO��NO2
��HO��NO2
![]() ��H2O
��H2O
C.������̼�������Һ����NaOH��Һ��Ӧ�����ӷ���ʽ��NH4++HCO3��+2OH��=NH3��+CO32+2H2O
D.CuCl2��ˮ�ⷽ��ʽ��Cu2+��2H2O![]() Cu(OH)2����2H+
Cu(OH)2����2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����(S2Cl2)�ǹ㷺������ҵ����������ӽṹ����ͼ��ʾ��������S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬��������ʹƷ����ɫ�����塣
����˵���������( )
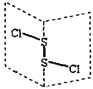
A. S2Cl2�ĽṹʽΪCl��S��S��Cl
B. S2Cl2Ϊ���м��Լ��ͷǼ��Լ��ķǼ��Է���
C. S2Br2��S2Cl2�ṹ���ƣ����Ӽ���������S2Br2>S2Cl2
D. S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ��2S2Cl2+2H2O=SO2��+3S��+4HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��U��W��ԭ���������������ǰ������Ԫ�أ�����Y��ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��ӣ�X��Z��δ�ɶԵ�������Ϊ2�� U���������ǵ�������Ԫ���γɵij������������W���ڲ����ȫ�����������ֻ��1�����ӡ���ش��������⣺
��1��X��Y��Z�ĵ縺�ԴӴ�С��˳����_______ (��Ԫ�ط��ű�ʾ����ͬ)������Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__________��
��2��д��Y�ļ۵����Ų�ʽ____��Wͬ���ڵ�Ԫ���У���Wԭ��������������ȵ�Ԫ�ػ���________��
��3�����ݵȵ�����ԭ������֪������XZ�Ľṹʽ��________, YZ2-��VSEPRģ����________��
��4��X��Y��Z�ļ��⻯��ļ��ǴӴ�С��˳����________ (�û�ѧʽ��ʾ)��ԭ����_____________��
��5��Y���⻯����Һ����ԭ����___________��
��6��XZ32-�����幹����________������Xԭ�ӵ��ӻ����������________����Ϊ�ȵ����������________��
��7���������ʾʽд��Z���⻯���д��ڵ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. NH3��CH4������ԭ�Ӷ���sp3�ӻ�
B. ��̬ԭ�ӵĺ�������Ų�Ϊ[Kr]4d105s1��Ԫ������d��
C. SO2��CO2����ֱ���η��ӣ�������ԭ�Ӷ���sp�ӻ�
D. �����ɵ��ܼ�ԾǨ���ϸ��ܼ�ʱ����ͨ��������ֱ����ȡԭ�ӵķ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com