
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的电子排布式为____,碳、氮、氧元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)NH4Cl中阳离子的空间构型为______,与NH4+互为等电子体的一种非极性分子的化学式为________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为_______(配位键用→表示)。
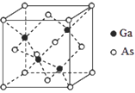
(4)GaAs与GaN均为原子晶体,GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_______。已知GaAs的密度为ρ g/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,阿伏伽德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为_______pm(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
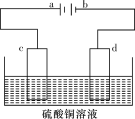
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品防腐剂R的结构简式如下图所示,下列说法正确的是( )
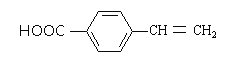
A.与CH3CH218OH发生酯化反应,生成H218O
B.与Na、NaOH、Na2CO3、NaHCO3溶液均反应
C.能使酸性高锰酸钾及溴水褪色,反应原理相同
D.1 mol化合物X最多能与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____(填标号)。

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;⑩NaOH
;⑩NaOH
(1)这些物质中,属于共价化合物的是______![]() 填序号,下同
填序号,下同![]() ;只含有离子键的是______;不含化学键的是______。
;只含有离子键的是______;不含化学键的是______。
(2)写出下列物质的结构式![]() ______;
______;![]() ______。
______。
(3)写出下列物质的电子式![]() ______;⑩NaOH______。
______;⑩NaOH______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH2(g)中的H-H键需要吸收436kJ能量,断裂1molI2(g)中的I-I键需要吸收151kJ能量,生成HI(g)中的1molH-I键能放出299kJ能量。下列说法正确的是
A.1molH2(g)和1molI2(g)的总能量为587kJ
B.H2(g)+I2(s)![]() 2HI(g)ΔH=-11kJ·molˉ1
2HI(g)ΔH=-11kJ·molˉ1
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)ΔH=+5.5kJ·molˉ1
I2(g)ΔH=+5.5kJ·molˉ1
D.H-H键比I-I键更容易断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com