
【题目】下面是同学们熟悉的物质:
①![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;⑩NaOH
;⑩NaOH
(1)这些物质中,属于共价化合物的是______![]() 填序号,下同
填序号,下同![]() ;只含有离子键的是______;不含化学键的是______。
;只含有离子键的是______;不含化学键的是______。
(2)写出下列物质的结构式![]() ______;
______;![]() ______。
______。
(3)写出下列物质的电子式![]() ______;⑩NaOH______。
______;⑩NaOH______。
【答案】②④⑦ ③ ⑧ ![]()
![]()
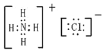
![]()
【解析】
![]() 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,由单原子分子形成的物质不含化学键;只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,当然注意个别特例;
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,由单原子分子形成的物质不含化学键;只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,当然注意个别特例;
![]() 过氧化氢、二氧化碳均通过共价键而使分子内的原子达到了稳定结构,据此可写结构式;
过氧化氢、二氧化碳均通过共价键而使分子内的原子达到了稳定结构,据此可写结构式;
![]() 氯化铵为离子晶体,由铵根离子与氯离子通过离子键结合在一起;氢氧化钠中钠离子与氢氧根离子通过离子键结合,氢氧根内部氧与氢原子共用1对电子;
氯化铵为离子晶体,由铵根离子与氯离子通过离子键结合在一起;氢氧化钠中钠离子与氢氧根离子通过离子键结合,氢氧根内部氧与氢原子共用1对电子;
![]() ①O2是单质,含有共价键;
①O2是单质,含有共价键;![]() 是化合物,只含共价键,为共价化合物;③MgCl2只含离子键,是离子化合物;④H2SO4是化合物,只含共价键,是共价化合物;
是化合物,只含共价键,为共价化合物;③MgCl2只含离子键,是离子化合物;④H2SO4是化合物,只含共价键,是共价化合物;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;![]() 是化合物,只含共价键,是共价化合物;⑧Ne为单原子分子,不含化学键;
是化合物,只含共价键,是共价化合物;⑧Ne为单原子分子,不含化学键;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;⑩NaOH化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;⑩NaOH化合物,既含有共价键又含有离子键,是离子化合物;
所以:属于共价化合物的是②④⑦;只含有离子键的是③;不含化学键的是⑧;
故答案为:②④⑦;③;⑧;
![]() 过氧化氢存在
过氧化氢存在![]() 和
和![]() 共价键,结构式为:
共价键,结构式为:![]() ,二氧化碳含有2个
,二氧化碳含有2个![]() 共价键,结构式为:
共价键,结构式为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 氯化铵为离子晶体,其电子式为:
氯化铵为离子晶体,其电子式为: ;氢氧化钠电子式为:
;氢氧化钠电子式为: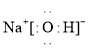 ;
;
故答案为: ;
;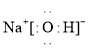 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是
A.V(H2)==0.1 mol/(L·min)B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)D.V(N2)==0.02mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )

A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
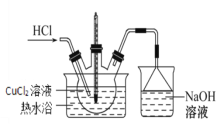
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是

A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向Ba(OH)2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1 醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是( )
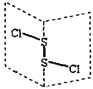
A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com