
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
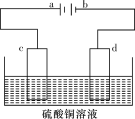
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
【答案】![]() 放热 BC ②④⑤ 2 1×10-3 mol·L-1 Cu2+ < Cu2++2e-=Cu 0.25
放热 BC ②④⑤ 2 1×10-3 mol·L-1 Cu2+ < Cu2++2e-=Cu 0.25
【解析】
(1)①根据K的含义和化学方程式书写K;②结合平衡常数与温度的关系判断平衡移动方向,分析判断吸热放热;③化学平衡的标志是正逆反应速率相等,平衡混合物中各物质的含量不变;
(2)碱或强碱弱酸盐其溶液都呈碱性;pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)生成沉淀需要的pH越小,则该离子先沉淀;先沉淀,说明溶度积小;
(4)①d与电源的负极相连,则d为阴极,溶液中的铜离子在阴极放电生成铜,电极反应为Cu2++2e-=Cu;
②根据阳极:Cu-2e-=Cu2+、阴极:Cu2++2e-=Cu, 两极质量差为16g,说明有8gCu参加反应,即转移电子物质的量为![]() ×2=0.25mol。
×2=0.25mol。
(1)①根据平衡常数的定义,此反应的平衡常数K=![]() ;
;
②化学平衡常数只受温度的影响,根据表格,温度升高,K降低,说明反应向逆反应方向进行,即此反应的正方向是放热反应;
③A、反应前后气体系数之和相等,压强不变,不能说明反应达到平衡;
B、根据化学平衡状态的定义,CO浓度不再改变说明反应达到平衡;
C、v正(H2)向正反应方向进行,v逆(H2O)向逆反应方向进行,且它们的速率之比等于化学计量数之比,说明反应达到平衡;
D、不知道开始时通入CO2和H2的量,因此两者浓度相等,不能说明反应达到平衡;
故答案为: ![]() ;放热;BC;
;放热;BC;
(2)①HCl的溶液显酸性;
②NaOH溶液显碱性;
③CH3COOH溶液显酸性;
④NH3·H2O溶液显碱性;
⑤CH3COONa是强碱弱酸盐,水溶液显碱性;
⑥NH4Cl属于强酸弱碱盐,水溶液显酸性;综上所述,溶液显碱性的是②④⑤;根据pH=-lgc(H+),0.01mol/LHCl溶液的c(H+)=0.01mol·L-1,即pH=2;水电离的一部分H+与CH3COO-结合生成CH3COOH,溶液中OH-完全是由水电离产生,即c(OH-)=Kw/c(H+)=10-14/10 -11mol·L-1=10-3mol·L-1;
故答案为:②④⑤;2;1×10-3 mol·L-1
(3)①这三个离子的水溶液显酸性,根据开始出现沉淀的pH,pH越小,加入NaOH溶液,最先出现沉淀,即Cu2+先沉淀;②先沉淀,说明溶度积小,因此Ksp[Fe(OH)2]<Ksp[Mg(OH)2];
故答案为: Cu2+;<;
(4)①d电极连接电源的负极,d电极为阴极,根据放电顺序,阴极电极反应式为Cu2++2e-=Cu;
②电镀时,铁作阴极,纯铜作阳极,阴极反应式为Cu2++2e-=Cu,阳极反应式为Cu-2e-=Cu2+,两极质量差为16g,说明有8gCu参加反应,即转移电子物质的量为![]() ×2=0.25mol。
×2=0.25mol。
故答案为:Cu2++2e-=Cu;0.25。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应![]() 正反应放热
正反应放热![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 | 700 | 700 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的平衡转化率α |
|
|
|
平衡常数K |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() ,
,![]() B.
B. ![]() ,
,![]()
C. ![]() ,
,![]() D.
D. ![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是
A.V(H2)==0.1 mol/(L·min)B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)D.V(N2)==0.02mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置示意图如图所示。下列有关该原电池的说法正确的是

A. 锌片是正极
B. 溶液中H+由铜电极移向锌电极
C. 铜片上有气泡产生
D. 电子由铜电极经导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求填空:
(1)![]() 在一可变的容积的密闭容器中进行
在一可变的容积的密闭容器中进行
①增加Fe的量,其反应速率的变化是______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,反应速率______________
③保持体积不变,充入N2使体系压强增大,其反应速率________
④保持压强不变,充入N2使容器的体积增大,其反应速率__________
(2)2HI(g) H2(g)+I2(g)(正反应为吸热反应)改变下列条件:
①减小容器体积:平衡____(填正移,逆移,不移动,以下相同)颜色___(加深,变浅,不变,以下相同)
②加热升高温度:平衡____________
③体积不变,充入H2:平衡_____________颜色_______________
(3)可逆反应2NO2(g) ![]() N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______
N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品是化学学习的基本要求。试回答以下问题:
(1)温度计、量筒、滴定管的一部分如图所示,下列读数(虚线所指刻度)及说法正确的是________(填字母代号)。
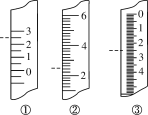
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.①是温度计,读数为2.5 ℃
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有________(填字母代号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管f.碱式滴定管
(3)实验室常见的几种气体发生装置如图A、B、C所示:
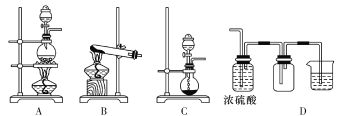
检查装置C气密性的操作方法是________________________。 若用装置A与装置D相连制取、收集气体X,则X可能是下列气体中的________(填数字序号)。
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )

A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是( )
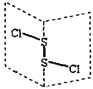
A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com