
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
【答案】B
【解析】
A选项,图甲所示实验可通过观察产生气泡的快慢,可以得到哪个反应速率快,哪个反应速率慢,就是主要看气泡的速度来得出,故A正确;
B选项,若图甲所示实验中反应速率为①>②,不能得出Fe3+比Cu2+对H2O2分解催化效果好,以为氯化铁和硫酸铜两者的阴阳离子都不相同,不能确定是阳离子还是阴离子起的催化作用,故B错误;
C选项,用图乙装置测定反应速率,根据相同时间内产生气体的体积来测反应速率或者生成相同体积所需时间的来测定反应速率,故C正确;
D选项,为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位,这就是检查乙装置的气密性的方法,故D正确;
综上所述,答案为B。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:

回答下列问题:
(1)A的结构简式为_____________,C的结构简式为_____________。
(2)B的化学名称为________。
(3)E是一种常见的塑料,其化学名称为_______________________。
(4)F与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出其水解反应化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、H2SO4、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HF、NH3、CH3OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子一定不是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑。生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气燃烧,该反应是___反应(填“吸热”或“放热”),这是由于反应物的总能量___(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量___(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。
(2)通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。
该电池的正极是___(填“a电极”或“b电极”),电极反应式为___,该电极上的物质发生反应的反应类型是___(填“氧化反应”或“还原反应”)。
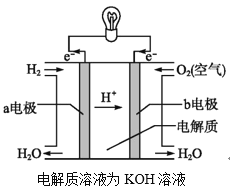
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铝的几种重要化合物之间的转化关系,下列表述不正确的是( )
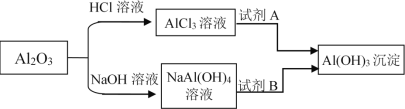
A.若加入的A是NaHCO3溶液,则生成沉淀的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液的pH增大
B.若加入的B是NaHCO3溶液,则生成沉淀的离子方程式为:Al(OH)4- + HCO3-=Al(OH)3↓+CO32-+H2O,溶液的pH减小
C.向AlCl3溶液中加入一定质量的Al(OH)3固体,一段时间后过滤,将所得固体洗涤干燥,称量,固体质量将增加
D.若加入的A是氨水、NaOH溶液或CH3COONa溶液等;或加入的B是NH4HCO3溶液、NH4Cl溶液或通入SO2、CO2气体等,均可析出Al(OH)3沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com