
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:

回答下列问题:
(1)A的结构简式为_____________,C的结构简式为_____________。
(2)B的化学名称为________。
(3)E是一种常见的塑料,其化学名称为_______________________。
(4)F与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出其水解反应化学方程式________。
【答案】CH3COOH ClCH2CH2OH 乙酸乙酯 聚氯乙烯 C2H5OSO3H + H2O → C2H5OH +H2SO4
【解析】
乙醇在浓硫酸加热的条件下发生消去反应得F为CH2=CH2,根据A的分子式可知,乙醇氧化得A为CH3COOH,A与乙醇发生酯化反应得B为CH3COOCH2CH3,乙醇与氯气发生取代反应得C为CH2ClCH2OH,C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为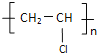 ,据此答题。
,据此答题。
(1)根据A由乙醇氧化得到可知,A为醛或酸,结合A的分子式可知,A为CH3COOH,乙醇与氯气在光照条件下发生取代反应生成C,乙醇分子中的一个氢原子被氯原子取代,生成ClCH2CH2OH,故答案为:CH3COOH,ClCH2CH2OH。
(2)乙酸与乙醇发生酯化反应生成乙酸乙酯,故答案为:乙酸乙酯。
(3)E的单体为D,C→D分子中减少了一分子水,故C生成D的反应为消去反应,D又发生聚合反应,则D为氯乙烯,所以E为聚氯乙烯,故答案为:聚氯乙烯。
(4)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇和硫酸,其水解的反应化学方程式为:C2H5OSO3H +H2O→C2H5OH+H2SO4,
故答案为:C2H5OSO3H +H2O→C2H5OH+H2SO4。


科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____(填标号)。

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
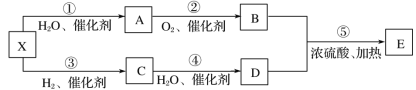
【题目】已知某气态烃X在标准状况下的密度为1.16g·L-1,A能发生银镜反应,E具有水果香味,有关物质的转化关系。
请回答:
(1)C中含有的官能团名称是_________。
(2)化合物M是A的同系物,比A少一个碳原子,请写出M的结构式_________。
(3)下列说法正确的是_________(填字母)。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物C分子中的所有原子在同一平面上
C.反应③为还原反应,反应④为氧化反应
D.有机物B、D、E均能与NaOH反应
(4)化合物E广泛用于药物、染料、香料等工业,实验室常用如图装置来制备E。装置中,溶液M为_________。反应结束后,将试管中收集到的产品倒入_________中,振荡、静置,然后_________(填操作)分离溶液M。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:______________________。
(2)写出下列物质的电子式: D元素形成的单质__________;E2B________________;A、B、E形成的化合物__________;D、E形成的化合物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物如KCN,化学方程式为:KCN+H2O2+KOH→K2CO3+NH3↑。
(1)在化学方程式上标出电子转移方向和数目___;
(2)反应中被氧化的元素为___,KOH的电子式为___;
(3)NH3分子中N—H键为__(填极性或非极性)共价键;
(4)H2O2属于___(填共价或离子)化合物;
(5)写出溶液中发生该反应时,生成的化学键类型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:O2>SO42-
D.检验溶液B中是否含Fe2+的方法:向溶液B中加入硫氰化钾溶液,无现象,然后加入双氧水溶液,观察是否变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com