
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
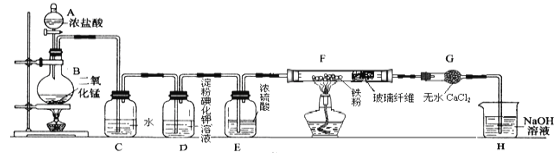
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+H2O=HCl+HClO 有色布条褪色 氯气与水反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色 Cl2+2I-=I2+2Cl- 防止氯化铁堵塞后面的导管 防止H中的水蒸气进入F中,使五水三氯化铁潮解 吸收多余的氯气,防止空气污染
MnCl2+Cl2↑+2H2O Cl2+H2O=HCl+HClO 有色布条褪色 氯气与水反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色 Cl2+2I-=I2+2Cl- 防止氯化铁堵塞后面的导管 防止H中的水蒸气进入F中,使五水三氯化铁潮解 吸收多余的氯气,防止空气污染
【解析】
(1)依据仪器形状说出其名称,实验室用加热二氧化锰与浓盐酸制取氯气据此解答;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,据此解答;
(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝;
(4)依据生成的固体氯化铁能堵塞导管,导致发生爆炸,氯化铁易吸水潮解的性质解答;
(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,据此解答。
(1)依据仪器形状可知仪器A的名称是分液漏斗;实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水,方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气与水反应生成盐酸和次氯酸,方程式为Cl2+H2O=HCl+HClO,次氯酸具有漂白性,从而使有色布条褪色,所以若将干燥的有色布条放入C中,观察到的现象是有色布条褪色;
(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝,离子方程式为Cl2+2I-=I2+2Cl-;
(4)由于氯化铁的熔点较低,容易冷凝堵塞导管,则双通管F中玻璃纤维(不参与反应)的作用是防止氯化铁堵塞后面的导管;氯化铁易吸水潮解,为防止H中的水蒸气进入F中,使五水三氯化铁潮解,所以应在F和H装置之间安装G装置;
(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠容易反应,H中NaOH溶液的作用是吸收多余的氯气,防止空气污染。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.25℃时,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)HA是________酸(选填“强”、“弱”)。NaA的水溶液显________性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
(5)在C点所得混合溶液中,下列说正确的是:___________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+) >c(A-)>c(H+)> c(OH-)。
C.c(Na+) +c(H+)=c(A─) +c(OH-)
D.c(HA)+c(A-)=0.2mol·L-1
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
(3)在25 ℃的条件下,向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)固体B的主要用途为(只写一种即可)______________;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___________、_______________;
(3)第③步中,生成氢氧化铝的离子方程式是___________________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH___ 7(填“大于”、“等于”或“小于”);
(2)写出步骤②在浆液中加入盐酸时发生反应的离子方程式 ___;
(3)步骤③所得滤渣的主要成分是____(填化学式),调节溶液pH至8~10,宜选用的试剂为 ___。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(6)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏低的是( )
A. 酸式滴定管未用待装溶液润洗
B. 碱式滴定管未用待装溶液润洗
C. 锥形瓶未用待装溶液润洗
D. 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B. 用如图所示方法可保护钢闸门不被腐蚀

C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com