
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)固体B的主要用途为(只写一种即可)______________;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___________、_______________;
(3)第③步中,生成氢氧化铝的离子方程式是___________________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
【答案】炼铁原料或用作涂料、油漆等 Al2O3+2OH-=2AlO2-+H2O SiO2+2OH-= SiO32-+ H2O Al3++3NH3H2O=Al(OH)3↓+ 3NH4+ Al(OH)3、H2SiO3 CO
【解析】
向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物、二氧化硅是酸性氧化物,二者均溶于氢氧化钠溶液中,Fe2O3不溶于碱,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,加入盐酸生成硅酸和氯化铝,氯化铝溶液中滴入氨水生成氢氧化铝,氢氧化铝受热分解,生成氧化铝,由此分析解答。
(1)向铝土矿中加入足量烧碱溶液后氧化铝和二氧化硅溶解,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁,氧化铁可作为炼铁的原料,氧化铁为红色,可用作涂料、油漆等;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝、二氧化硅溶解,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(3)试剂③为氨水,将铝离子转化为氢氧化铝沉淀,离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+;若往A溶液中通入足量CO2,硅酸根离子和偏铝酸根离子反应生成硅酸和氢氧化铝,因此产生的沉淀为Al(OH)3、H2SiO3;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5 mol碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1mol·L-1的Na0H 溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是

A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+)>c(Cl-)>c(OH-)>c(BOH)
C. b点时两种协液中水的电离程度相同.且V=20
D. c、d两点溶液混合后微粒之间存在关系:c(H+)= c(OH-)+c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:


回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(写出计算步骤)(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读材料,完成下列问题。
海底盐池是近些年海洋科学家的一项重要发现,分布在世界多处埋有盐层的海域,目前人类已探明的海底盐池主要分布在红海、地中海、墨西哥湾、黑海、南极大陆架。盐池池面与普通海水之间有着清晰可见的分界。数不清的贝类与鱼虾在波光粼粼的盐池周围生活,但一旦生物进入盐池内就会死亡。研究人员还从盐池中采集了可以适应池中环境的生物样本,分析之后认为这类生物可能会在太阳系中某一行星上生存,甚至可能在太阳系之外也会存在。
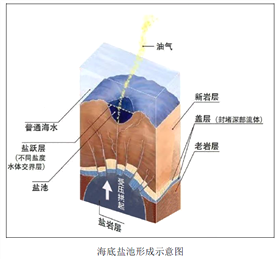

(1)结合材料,分析海底盐池的形成条件。
(2)简析池面与普通海水之间有明显分界的原因。
(3)推测生物一旦进入这个海底盐池就会死亡的原因。
(4)“海底盐池”会受到哪些领域专家的关注,并简述对“海底盐池”开展科考的现实意
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
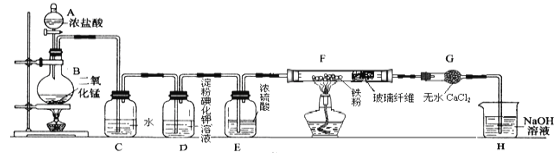
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液

(1)这4种溶液pH由大到小的顺序是____(填序号),其中②由水电离的H+浓度为____。
(2)①中各离子浓度由大到小的顺序是 ___。
(3)④的水解平衡常数Kh=___mol/L。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③___ ④(填“>”、“<"、“=”)
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则![]() 约为____。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:____。
约为____。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 第④步电解得到,镁的方程式为MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 提取镁的过程涉及化合、分解、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com