
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
【答案】静置,向上层清液中继续滴加BaCl2溶液,若无浑浊出现,则证明BaCl2过量(合理即可) H++OH-=H2O 2H++CO32-=CO2+H2O 2.9g 250ml容量瓶 胶头滴管 A BC
【解析】
由题意知,把粗盐溶于水后,加入稍过量的氯化钡溶液除硫酸根,再加入过量的氢氧化钠溶液除去粗盐中的镁离子,再加入稍过量的碳酸钠溶液除去过量的钡离子和粗盐中的钙离子,过滤后,向滤液中加入适量的盐酸除去过量的氢氧化钠和碳酸钠后,蒸发、结晶、烘干得到精盐。
(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②静置后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)由于加入的氢氧化钠和碳酸钠都是过量的,所以需要在步骤⑥加入适量盐酸除去,反应的离子方程式分别为:H++OH-=H2O、2H++CO32-=CO2+H2O;
(3)为检验精盐纯度,需配230mL 0.2mol/L NaCl(精盐)溶液,由于没有230mL的容量瓶,需选择250mL的容量瓶配制250mL溶液,并且按照250mL溶液计算出所需氯化钠的质量为0.25L×0.2mol/L×58.5g/mol=2.925g,则需用托盘天平称取精盐固体的质量为2.9g;需要的玻璃仪器有量筒、 烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(4)配制NaCl(精盐)溶液时,若出现下列操作:
A.称量时NaCl已潮解,则称量氯化钠的质量偏小,所配溶液浓度偏低;
B. 称取时砝码与物体放反了,所称量溶质质量偏小,所配溶液浓度偏低;
C.定容、摇匀后,液面下降又加水,溶液体积偏大,所配溶液浓度偏低;
D.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高;
其结果偏高的是ABC。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
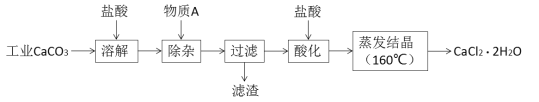
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作_______极(填“阴”或“阳”)。
(2)Se与S处于同一主族,比S原子多1个电子层,Se的原子序数为____________;其最高价氧化物的化学式为________;该族 2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJmol1 b.+29.7 kJmol1 c.-20.6 kJmol1 d.-241.8 kJmol1
表示生成 1 mol硒化氢反应热的是________________(填字母代号)。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式___________。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_________。
③ 写出步骤ⅱ中的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的化学方程式或离子方程式:
(1)Na和H2O反应的离子方程式___________________ ;
(2) Al2O3和NaOH反应的离子方程式___________________ ;
(3)Al和NaOH溶液反应的离子方程式___________________ ;
(4)Na2O2和CO2反应的化学方程式___________________ ;
(5) NaHCO3受热分解的化学方程式___________________ ;
(6)Fe与水蒸气在高温下反应化学方程式___________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“质量摩尔浓度”也是一种表示溶液组成的物理量,溶质B的质量摩尔浓度是用单位质量的溶剂中所含溶质B的物质的量来表示溶液组成的物理量,单位为molkg-1或molg-1,已知20°C时质量分数为20%的NaOH溶液的密度为1.16 gcm-3,则该溶液的质量摩尔浓度为
A.6.25 molkg-1B.4.25 molkg-1C.6.25 molg-1D.4.25 molg-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
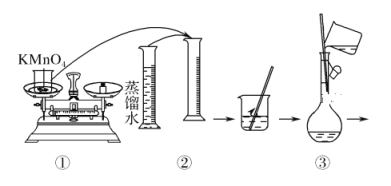
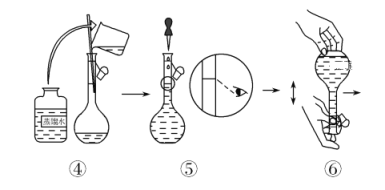
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
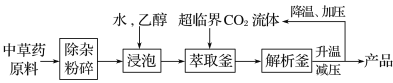
下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com