
【题目】“质量摩尔浓度”也是一种表示溶液组成的物理量,溶质B的质量摩尔浓度是用单位质量的溶剂中所含溶质B的物质的量来表示溶液组成的物理量,单位为molkg-1或molg-1,已知20°C时质量分数为20%的NaOH溶液的密度为1.16 gcm-3,则该溶液的质量摩尔浓度为
A.6.25 molkg-1B.4.25 molkg-1C.6.25 molg-1D.4.25 molg-1
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为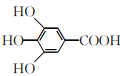 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2 mol NH3。下列有关比较中正确的是
A.体积大小:②>③>①>④
B.质量大小:②>③>④>①
C.氢原子数目多少:④>①>③>②
D.摩尔质量的大小:④>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某植物的叶肉细胞链于适宜沮度和充足的14CO2条件下,先给予一段时间光照,然后再停止光照,检测整个过程叶肉细胞的叶绿体中放射性C3浓度的变化情况,结果如下图.回答下列问题。
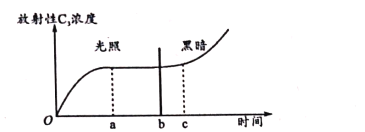
(1)叶肉细胞以14CO2为原料,生成C3的场所是____。图中a~b段放射性C3浓度基本不变,原因是____。
(2)图示结果显示,停止光照后的b~c时间段内,叶肉细胞中放射性C3的浓度并没有上升,原因是____。
(3)某实验小组对叶肉细胞交替进行光照和黑暗处理(先光照后黑暗,每次光照与黑暗处理的时间相同;各组光照强度和处理的总时间也相同),随着光照和黑暗交替频率的增加,推测叶肉细胞光合作用中CO2的同化总量最可能____(填增加或减少或不变),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图![]() ),含有NA个S—S键
),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com