
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
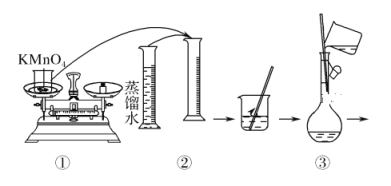
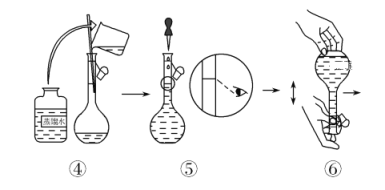
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】由前18号元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
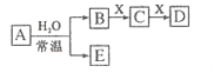
A. 若D为白色沉淀,与A摩尔质量相等,则X一定是含铝元素的盐
B. 若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其阳离子与阴离子比为2:1
D. 若X是Na2CO3,C为CO2分子,则A一定是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A. x=0.6a,2Br-+Cl2===Br2+2Cl-
B. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
C. x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D. x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H216O和H218O属于同位素
B.相同体积的CO2、NO2具有相同的分子数
C.NaCl溶液能导电,所以NaCl溶液是电解质
D.配制溶液时,容量瓶中原来有少量蒸馏水不会影响实验结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是
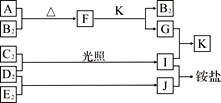
A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:

已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)为了加快浸取的反应速率,可以采取的措施_________________________________
(2)步骤II中加入H2O2溶液的作用是_________________________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是___________________________________________;所得活性氧化锌的纯度为________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com