
【题目】下列说法正确的是( )
A.H216O和H218O属于同位素
B.相同体积的CO2、NO2具有相同的分子数
C.NaCl溶液能导电,所以NaCl溶液是电解质
D.配制溶液时,容量瓶中原来有少量蒸馏水不会影响实验结果
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】关于中和热测定实验的下列说法不正确的是
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃搅拌棒既可以搅拌又避免损坏温度计
C. 向盛装酸的烧杯中加碱时要小心缓慢
D. 测酸后的温度计要用水清洗后再测碱的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O
S4O![]()
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________________。
(2)取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧量,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为___________ mg·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
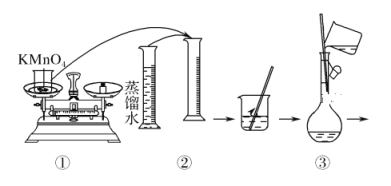
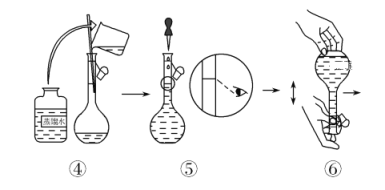
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是 ( )
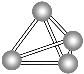
A. N4与N2互为同分异构体
B. N4分子中只含有共价键
C. 1 mol N4分子所含共价键数为4NA
D. N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1) “酸浸”时加入一定量的硫酸,硫酸不能过多或过少。“硫酸”过多造成氨的损失;硫酸过少时,“酸浸”时会有红褐色渣出现,原因是________________________。
(2)加入氨水应调节pH的范围为__________________,当Fe3+恰好沉淀完全时,c(Al3+)=_____________mol·L-l。
(3)“过滤”所得滤渣为MnCO3,滤液中溶质的主要成分是____________(填化学式),写出其阳离子的电子式:_______________________________。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_______________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是________________________________________________。

(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别乙醇、苯和溴苯,最简单的方法是( )
A. 加入金属钠B. 加酸性高锰酸钾溶液后振荡,静置
C. 加蒸馏水后振荡,静置D. 加硝酸银溶液后振荡,静置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com