
【题目】硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作_______极(填“阴”或“阳”)。
(2)Se与S处于同一主族,比S原子多1个电子层,Se的原子序数为____________;其最高价氧化物的化学式为________;该族 2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJmol1 b.+29.7 kJmol1 c.-20.6 kJmol1 d.-241.8 kJmol1
表示生成 1 mol硒化氢反应热的是________________(填字母代号)。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式___________。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_________。
③ 写出步骤ⅱ中的化学方程式______________________。
【答案】阴 34 SeO3 b CuSe+4H2SO4(浓)![]() CuSO4+3SO2↑+SeO2↑+4H2O Na2SeO3 2SO2+SeO2+2H2O=Se+H2SO4
CuSO4+3SO2↑+SeO2↑+4H2O Na2SeO3 2SO2+SeO2+2H2O=Se+H2SO4
【解析】
同主族元素最外层电子数相同,电子层数从上而下增加,非金属性逐渐减弱,最高价、最低价相同,最高价氧化物、最高价氧化物的水化物,氢化物写法相同,同类化合物具有相似的性质。
(1)电解精炼铜时,粗铜做阳极,发生氧化反应,生成铜离子以及其他金属阳离子,精铜做阴极,只有铜离子发生还原反应生成铜,可达到提纯的目的,答案为:阴;
(2)Se与S处于同一主族,Se比S原子多1个电子层,则Se的原子序数为16+18=34;其最高价与硫一样为+6价,对应有氧化物为SeO3;该族2~5周期元素的单质的活泼性为:氧气>硫>硒>碲,单质越活泼与H2反应生成1mol氢化物放出的热量越多,则表示生成1mol硒化氢反应热的是b,故答案为:34;SeO3;b;
(3)①CuSe与浓H2SO4反应生成SO2、SeO2的混合气体,同时生成硫酸铜,反应的化学方程式为:CuSe+4H2SO4(浓)![]() CuSO4+3SO2↑+SeO2↑+4H2O;
CuSO4+3SO2↑+SeO2↑+4H2O;
②少量SO2与NaOH溶液反应生成的盐是Na2SO3,故少量SeO2与NaOH溶液反应生成一种盐,该盐化学式为Na2SeO3;
③SO2与SeO2的混合气体在水溶液里发生氧化还原反应,反应生成了Se,Se的化合价降低,故S的化合价应该升高到+6,在溶液里生成硫酸,根据得失电子守恒和质量守恒写出化学方程式,该反应的化学方程式为:2SO2+SeO2+2H2O=Se+H2SO4。


科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是( )
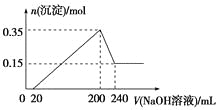
A.镁和铝的总质量为9 g
B.合金与稀硫酸反应生成的氢气体积为10.08 L
C.稀硫酸的物质的量浓度为2.5 mol/L
D.氢氧化钠溶液的物质的量浓度为5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为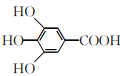 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用系统命法写出下列物质名称或结构简式
(1)用系统命法命名
①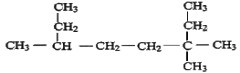 _________。
_________。
② 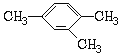 _________________。
_________________。
(2)顺-2-丁烯的结构简式为:____________。
(3)3-甲基-1-丁烯的结构简式为:_____________。
(4)2,2,3,3-四甲基戊烷的结构简式为:____________
(5)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某植物的叶肉细胞链于适宜沮度和充足的14CO2条件下,先给予一段时间光照,然后再停止光照,检测整个过程叶肉细胞的叶绿体中放射性C3浓度的变化情况,结果如下图.回答下列问题。
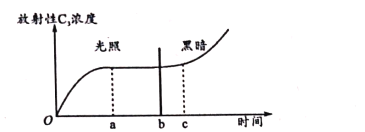
(1)叶肉细胞以14CO2为原料,生成C3的场所是____。图中a~b段放射性C3浓度基本不变,原因是____。
(2)图示结果显示,停止光照后的b~c时间段内,叶肉细胞中放射性C3的浓度并没有上升,原因是____。
(3)某实验小组对叶肉细胞交替进行光照和黑暗处理(先光照后黑暗,每次光照与黑暗处理的时间相同;各组光照强度和处理的总时间也相同),随着光照和黑暗交替频率的增加,推测叶肉细胞光合作用中CO2的同化总量最可能____(填增加或减少或不变),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com