
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
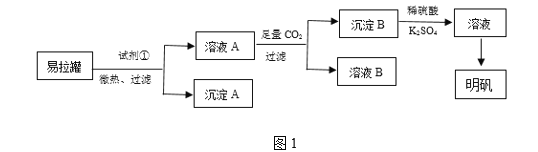
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
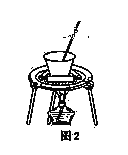
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
【答案】d 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3- Al(OH)3 NaHCO3 冷却结晶 蒸发不能使用坩埚,应使用蒸发皿 75%
【解析】
易拉罐的主要成分为Al,含有少量的Fe、Mg杂质,可选择浓NaOH溶解,得到偏铝酸钠溶液(溶液A),并通过过滤除去Fe、Mg(沉淀A)等杂质,滤液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),过滤后将沉淀溶解在稀硫酸中,得到硫酸铝溶液,添加K2SO4溶液后蒸发浓缩并冷却结晶得到晶体明矾,据此分析解答。
(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质;
故答案为:d;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;通入足量二氧化碳发生的反应生成氢氧化铝和碳酸氢钠,离子方程式AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3-,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+2H2O+CO2= Al(OH)3 ↓+HCO3-;
(3)根据分析可知,偏铝酸钠溶液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),溶液B为NaHCO3溶液;
故答案为:Al(OH)3;NaHCO3;
(4)硫酸铝溶液中添加K2SO4溶液后蒸发浓缩并冷却结晶、过滤、洗涤、干燥得到晶体明矾;蒸发不能使用坩埚;
故答案为:冷却结晶;蒸发不能使用坩埚;
(5)根据铝元素守恒,AlKAl(SO4)212H2O,理论上可得到明矾的质量为:![]() =158g,则明矾的回收率为
=158g,则明矾的回收率为![]() ×100%=75%;
×100%=75%;
故答案为:75%。


科目:高中化学 来源: 题型:
【题目】在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是()
A.Fe2++![]() +Ba2++2OH-=BaSO4↓+Fe(OH)2↓
+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.![]() +Fe2++ 2
+Fe2++ 2![]() + 2Ba2++ 3OH-=2BaSO4↓+ Fe(OH)2↓+ NH3·H2O
+ 2Ba2++ 3OH-=2BaSO4↓+ Fe(OH)2↓+ NH3·H2O
C.2Fe3++ 3![]() + 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3![]() + Fe3++3
+ Fe3++3![]() + 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
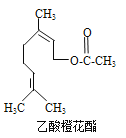
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③B. ①②⑤C. ①②⑤⑥D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 广泛存在于天然气等燃气及废水中,热分解或氧化
广泛存在于天然气等燃气及废水中,热分解或氧化![]() 有利于环境保护并回收硫资源。
有利于环境保护并回收硫资源。
(1)Binoist等进行了![]() 热分解实验:
热分解实验:![]() ,开始时,
,开始时,![]() 与
与![]() 的体积比为1:19.在压强为
的体积比为1:19.在压强为![]() 下测得在三种不同温度下
下测得在三种不同温度下![]() 的转化率如图1所示.
的转化率如图1所示.
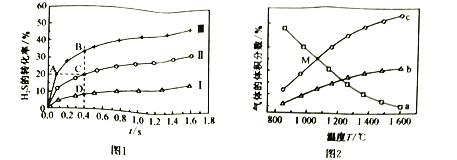
![]() 分解反应的
分解反应的![]() ______________(填“>”或“<”)0,A、B、C、D四点中:
______________(填“>”或“<”)0,A、B、C、D四点中:![]() 最大的是__________________,
最大的是__________________,![]() 最大的是___________,容器中
最大的是___________,容器中![]() 的分压由大到小的关系是__________________。
的分压由大到小的关系是__________________。
(2)当![]() 与
与![]() 混合,在
混合,在![]() 及不同温度下反应达平衡时
及不同温度下反应达平衡时![]() 及
及![]() 的体积分数如图2所示。图中b表示的物质是___________,M点时,反应
的体积分数如图2所示。图中b表示的物质是___________,M点时,反应![]() 的平衡常数
的平衡常数![]() ____________________
____________________![]() (
(![]() 为以分压表示的平衡常数,保留两位小数)
为以分压表示的平衡常数,保留两位小数)
(3)用氯气除去废水中![]() 的反应为
的反应为![]() ,该反应的可能机理如下:
,该反应的可能机理如下:
a.![]() 慢 b.
慢 b.![]() 快
快
![]() 快
快 ![]() 慢
慢
![]() 快
快 ![]() 快
快
c.![]() 慢 d.
慢 d.![]() 快
快
![]() 快
快 ![]() 慢
慢
①机理a的中间体为______________________。
②已知![]() ,
,![]() 为正反应速率,k为速率常数,上述机理中与该速率方程一致的是_________________________(填字母)。
为正反应速率,k为速率常数,上述机理中与该速率方程一致的是_________________________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
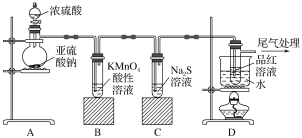
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是_____、 ____,这些现象分别说明SO2具有的性质是____和____。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用系统命法写出下列物质名称或结构简式
(1)用系统命法命名
①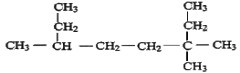 _________。
_________。
② 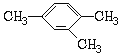 _________________。
_________________。
(2)顺-2-丁烯的结构简式为:____________。
(3)3-甲基-1-丁烯的结构简式为:_____________。
(4)2,2,3,3-四甲基戊烷的结构简式为:____________
(5)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com