
【题目】设NA表示阿伏加德罗常数,下列说法正确的是()
A.常温常压下,23 g NO2和N2O4的混合气体一定含有含有NA个氧原子
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个![]()
C.将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA
D.1 mol Cl2与足量的NaOH溶液发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,转移2NA个电子
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:


(1)写出物质甲中含氧官能团的名称:________________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为_____________,反应Ⅱ的化学方程式为____________(注明反应条件)。
(3)已知:RCH===CHR′![]() RCHO+R′CHO;
RCHO+R′CHO;
2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):

①物质B化学名称为________________,下列物质能与C反应的是________(选填序号)。
a.银氨溶液 b.溴水 c.Na2CO3溶液 d.酸性KMnO4溶液
②写出E→F化学方程式_______________________________________________。
③D的同分异构体中同时满足下列要求的有________种。
a.遇FeCl3溶液显示特征颜色
b.1molD能与2molNaOH溶液反应
c.核磁共振氢谱图中有四个峰,峰面积之比为3:2:2:1
④综上分析,丙的结构简式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是新型镁一锂双离子二次电池。下列关于该电池的说法正确的是
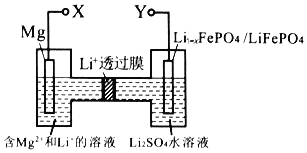
A.放电时,Li+由右向左移动
B.放电时,正极的电极反应式为Li1-x-FePO4+xLi++xe-=LiFePO4
C.充电时,外加电源的负极与Y相连
D.充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的叙述中,正确的是( )
A. 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. Fe(OH)3胶体微粒能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
D. Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的量的相关公式计算:
(1)16gO3和16g O2分子数之比为________,含氧原子数之比为________;
(2)12.7g FeCl2固体溶于水配成500mL溶液,其浓度为________molL-1,从该溶液中取出100mL溶液,其中C1-的浓度为________molL-1;
(3)某金属氯化物MCl227g,含有0.40 mol Cl-,则该氯化物的物质的量为________,M的摩尔质量为________。
(4)下列数量的各物质所含原子数按由大到小的顺序排列的是____________。
①34g氨气 ②标准状况下44.8L氦气 ③25°C时18 mL水 ④0.5 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
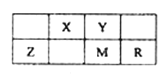
A. 元素的非金属性次序为:Y>X>M
B. 气态氢化物稳定性:M>R
C. Z的氧化物可以做光导纤维
D. 最D高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=_______________,升高温度,K值_______(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_______:
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是()
A.NH4HCO3溶液与过量KOH浓溶液共热:![]() + OH-
+ OH-![]() NH3↑+ H2O
NH3↑+ H2O
B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++ OH- + H+ +![]() = BaS04↓+ H2O
= BaS04↓+ H2O
C.醋酸铅溶液通入硫化氢气体的反应:Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
D.向NaAlO2溶液中通入过量CO2:2![]() + CO2 + 3H2O = 2Al(OH)3↓+
+ CO2 + 3H2O = 2Al(OH)3↓+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com