
����Ŀ����Ҫ����գ�
(1)��______ molAl2(SO4)3�к�0.3molSO42- ����Al3+Լ_______________����
(2)����£�11.2LNH3������Ϊ��____________g��
(3)20gij���۽����Ȼ��ACl2���к���0.4mol Cl-����ACl2��Ħ��������_________��
(4)��100mLFe2(SO4)3��Һ�к�Fe3+11.2 g������Һ��Fe3+Ũ��____________��ȡ����Һ25ml��ˮϡ����300mL�����ʱϡ��Һ��SO42�������ʵ���Ũ��Ϊ____________��
(5)�ڱ���£�22.4L�ɵ�����������ɵĻ�����壬������Ϊ30g��������������Ϊ______g��
���𰸡�0.1 1.204��1023 8.5 100g/mol 2mol/L 0.25mol/L 16
��������
���ù�ʽn=![]() =
=![]() =
=![]() ��������֮��Ĺ�ϵ���м��㡣
��������֮��Ĺ�ϵ���м��㡣
(1)1Ħ�� Al2(SO4)3�к���3molSO42-����0.3molSO42-ʱ��Al2(SO4)3�����ʵ���Ϊ0.1mol����Al3+0.2mol��Լ0.2mol��6.02��1023������1.204��1023����
(2)n��NH3��=![]() =
=![]() =0.5mol��m=0.5mol��17g/mol=8.5g��
=0.5mol��m=0.5mol��17g/mol=8.5g��
(3)һ��ACl2�к���2Cl-����0.4mol Cl-ʱ��ACl2���ʵ���Ϊ0.2mol��M��ACl2��=![]() =100g/mol��
=100g/mol��
(4) 11.2 g Fe3+�����ʵ���=![]() =0.2mol��c��Fe3+��=
=0.2mol��c��Fe3+��= ![]() =
=![]() =2mol/L����Һϡ��ʱ�����ʵ����ʵ������䣬���������У�N��Fe3+����N��SO42����=2��3����c��SO42����=3mol/L��c1��SO42������300mL=3mol/L��25mL����c1��SO42����=0.25mol/L��
=2mol/L����Һϡ��ʱ�����ʵ����ʵ������䣬���������У�N��Fe3+����N��SO42����=2��3����c��SO42����=3mol/L��c1��SO42������300mL=3mol/L��25mL����c1��SO42����=0.25mol/L��
(5) ����£�22.4L�������������ܵ����ʵ���Ϊ1mol����������ƽ��Ħ������M=![]() =
=![]() =30g/mol����ʮ�ֽ��淨��
=30g/mol����ʮ�ֽ��淨��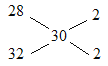 ��n��N2����n��O2��=1��1��n��O2��=0.5mol��������Ϊ0.5mol��32g/mol=16g��
��n��N2����n��O2��=1��1��n��O2��=0.5mol��������Ϊ0.5mol��32g/mol=16g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300����ǰ��������ѧ�Ҳ����������������ûʳ�������ɫ��Ӧ�����ɴ˷���������īˮ��ûʳ����Ľṹ��ʽΪ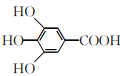 �����й���ûʳ�����˵����ȷ����
�����й���ûʳ�����˵����ȷ����
A. ����ʽΪC7H7O5
B. �ܷ����ӳɷ�Ӧ����ȥ��Ӧ��ȡ����Ӧ
C. 1 molûʳ������������̼�����Ʒ�Ӧ������4 mol CO2
D. 1 molûʳ�������������Ʒ�Ӧ������2 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijֲ���Ҷ��ϸ���������˾ڶȺͳ����14CO2�����£��ȸ���һ��ʱ����գ�Ȼ����ֹͣ���գ������������Ҷ��ϸ����Ҷ�����з�����C3Ũ�ȵı仯������������ͼ.�ش��������⡣
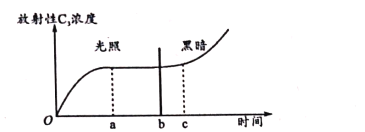
��1��Ҷ��ϸ����14CO2Ϊԭ�ϣ�����C3�ij�����____��ͼ��a~b�η�����C3Ũ�Ȼ������䣬ԭ����____��
��2��ͼʾ�����ʾ��ֹͣ���պ��b��cʱ����ڣ�Ҷ��ϸ���з�����C3��Ũ�Ȳ�û��������ԭ����____��
��3��ijʵ��С���Ҷ��ϸ��������й��պͺڰ��������ȹ��պ�ڰ���ÿ�ι�����ڰ�������ʱ����ͬ���������ǿ�Ⱥʹ�������ʱ��Ҳ��ͬ�������Ź��պͺڰ�����Ƶ�ʵ����ӣ��Ʋ�Ҷ��ϸ�����������CO2��ͬ�����������____�������ӻ���ٻ䣩��ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.1LpH=6�Ĵ�ˮ�к���OH������ĿΪ10��8NA
B.����������ȼ�ϵ����ת��2mol����ʱ�������ķ�����ΪNA
C.0.5mol�ۻ�(As4S4���ṹ��ͼ![]() )������NA��S��S��
)������NA��S��S��
D.һ�����������ܱ������г���1molH2��2molH2(g)��ַ�Ӧ������HI������������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�HCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ����ͼ���ش��������⣺
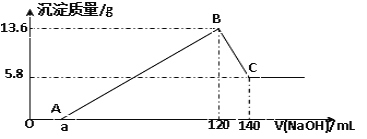
��1��д��OA�κ�BC�η�Ӧ�����ӷ���ʽ�� OA��___________ �� BC��___________��
��2��ԭNaOH��Һ�����ʵ���Ũ���Ƕ���________��
��3��ԭMg-Al�Ͻ�������Ƕ���________g?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������µ�ʵ�鷽�����ⶨþ���Ͻ�����������������
����һ����m1gþ���Ͻ����ܽ����������Լ�X�У���ַ�Ӧ���ˡ�ϴ�ӡ�����������õ�����Ϊm2 g�Ĺ��塣
��1���Լ�X��_____����Ӧ�����ӷ���ʽ��____��
��2�������ʵ��Ĺ����У�û�жԹ������ϴ�ӣ�������������������_____������ƫ������ƫС��������Ӱ��������
��������ѡ����ͼ��ʾ��װ�ú�ҩƷ��

��3����װ�������Ժ���Ҫ���е�ʵ�������_____��
��4������a��������______��
��5������ʱ��Ҫע���������_____��
��6������Ͻ��������a g�������������Ϊb L���ѻ���Ϊ��״��ʱ�����������Ͻ�����������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����̼�任��ӦCO + H2O![]() CO2 + H2�У��йط�Ӧ�����ı�ʹ��Ӧ���������ԭ���������ȷ����
CO2 + H2�У��йط�Ӧ�����ı�ʹ��Ӧ���������ԭ���������ȷ����
A.ʹ�ô���������Ӱٷ���������Ч��ײ��������
B.�����¶ȣ�����Ӱٷ���������Ч��ײ��������
C.����ѹǿ����λ����ڻ���������࣬��Ч��ײ��������
D.����c(CO)������Ӱٷ���������Ч��ײ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����nAΪ����٤����������ֵ������˵����ȷ����
A. 23g Na ������H2O��Ӧ��ȫ�������nA��H2����
B. 1 molCu��������Ũ���ᷴӦ������nA��SO3����
C. ��״���£�22.4L N2��H2������к�nA��ԭ��
D. 3mol����Fe��ȫת��ΪFe3O4��ʧȥ8nA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2O2��Na2CO3��ɵĹ���������200mLϡ����պ÷�Ӧ��ȫ���ռ�����״���µ�����3.36L��������Һ�к�NaCl 0.4mol������˵���������
A.ϡ��������ʵ���Ũ����2 mol/L
B.ԭ����������Na2O2��������7.8g
C.������Ӧ�����У�Na2O2��Na2CO3��������������Ϊ1:1
D.�û�������ƽ��Ħ������Ϊ40 g/ mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com