
【题目】Na2O2和Na2CO3组成的固体混合物与200mL稀盐酸刚好反应完全后,收集到标准状况下的气体3.36L,所得溶液中含NaCl 0.4mol,下列说法错误的是
A.稀盐酸的物质的量浓度是2 mol/L
B.原固体混合物中Na2O2的质量是7.8g
C.上述反应过程中,Na2O2和Na2CO3产生气体的体积比为1:1
D.该混合气体的平均摩尔质量为40 g/ mol
【答案】C
【解析】
A.由原子守恒得,氯化氢的物质的量等于氯化钠的物质的量,c(HCl)=n÷V=0.4mol÷0.2L=2 mol/L,故A正确;
B.设Na2O2物质的量是xmol,Na2CO3物质的量是ymol,反应的化学方程式为2Na2O2+4HCl=4NaCl+2H2O+O2↑、Na2CO3+2HCl=2NaCl+H2O+CO2↑,2x+2y=0.4mol;![]() +y=3.36L÷22.4L/mol=0.15mol,解得x=0.1,y=0.1,所以Na2O2的质量是7.8g,故B正确;
+y=3.36L÷22.4L/mol=0.15mol,解得x=0.1,y=0.1,所以Na2O2的质量是7.8g,故B正确;
C.根据B分析知,过氧化钠的物质的量是0.1mol,生成氧气是0.05mol,碳酸钠的物质的量是0.1mol,与盐酸反应产生二氧化碳的物质的量是0.1mol,产生气体体积比是1:2,故C错误;
D.根据C分析知,氧气的物质的量是0.05mol,二氧化碳的物质的量是0.1mol,可以得气体的质量是0.05mol×32g/mol+0.1mol×44g/mol=6g,混合气体的平均摩尔质量为6g÷0.15mol=40 g/ mol,故D正确;
故选:C。


科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在______ molAl2(SO4)3中含0.3molSO42- ,含Al3+约_______________个。
(2)标况下,11.2LNH3的质量为:____________g。
(3)20g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_________。
(4)在100mLFe2(SO4)3溶液中含Fe3+11.2 g,则溶液中Fe3+浓度____________,取该溶液25ml加水稀释至300mL,则此时稀溶液中SO42﹣的物质的量浓度为____________。
(5)在标况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则氧气的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)配平化学方程式。__FeCl3+__SO2+__H2O=__FeCl2+__H2SO4+__HCl。
(2)除去括号中的杂质,写出除杂反应的离子方程式
①Na2SO4溶液(Na2CO3):_______________________________________________。
②Ca(NO3)2溶液(CaCl2):_______________________________________________。
(3)写出下列反应的离子方程式:
①向烧碱溶液中通入少量CO2气体:_______________________________________________。
②向澄清石灰水中滴加足量的碳酸氢钠溶液:_______________________________________________。
(4)实验室中,制取Fe(OH)3胶体的离子方程式是_______________________________________________,
证明胶体已经制成的方法是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在家中进行化学实验,按照图A连接好线路发现灯泡不亮,按照图B连接好线路发现灯泡亮.
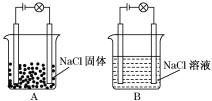
依据上述现象判断或回答下列问题:
(1)NaCl属于________(“酸”、“碱”或“盐”),因为__________________________.
(2)NaCl固体________(填“能”或“不能”)导电,原因是_____________________.
(3)NaCl溶液________(填“能”或“不能”)导电,原因是__________________.
(4)在NaCl固体、NaCl溶液中属于电解质的是_________________________________,
原因是____________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和H2为原料制取乙醇的反应为 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下 的密闭容器中,按CO2和H2的物质的量比为 1∶3 投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示。下列说法正确的是
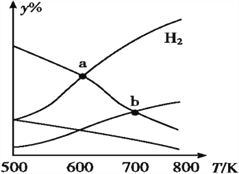
A. a点的平衡常数小于b点 B. b点:v正(CO2)=v逆(H2O)
C. a点:n(H2)=n(H2O) D. 温度不变,充入更多H2,v(CO2)始终不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com