
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某种激光染料,它由C、H、O三种元素组成,分子球棍模型如图所下列有关叙述正确的是

①分子式为C10H8O3 ②不溶于水 ③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2 mol NaOH的溶液反应
A. ①②③④ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。试根据表中数据计算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数,下列说法正确的是
A. T℃时,1LpH=6纯水中,含10-8NA个OH-
B. 15.6gNa2O2 与过量CO2反应时,转移的电子数为0.4NA
C. pH=1的H3PO4溶液中含有0.1NA个H+
D. 1molCO和N2混合气体中含有的质子数是14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属铷(Rb)的叙述中,正确的是( )
A. 灼烧氯化铷时,火焰有特殊颜色B. 硝酸铷是共价化合物,易溶于水
C. 在钠、钾、铷三种单质中,钠的金属性最强D. 氢氧化铷是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 5.6gFe和足量的盐酸完全反应失去电子数为0.2NA
B. 22.4LSO2含有NA个SO2分子
C. 1.6gCH4所含的电子数为NA
D. 标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸氯苯那敏又名扑尔敏(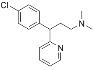 )是一种常见的抗过敏药物,其合成路线如下:
)是一种常见的抗过敏药物,其合成路线如下:
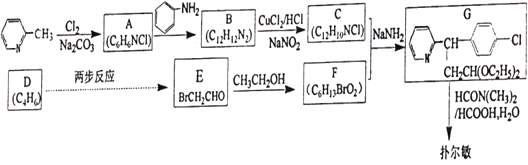
已知:碳碳双键可以被臭氧氧化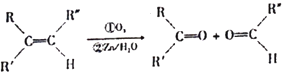
请回答下列问题:
(1)下列说法中不正确的是________。
A.扑尔敏的分子式为C16H18N2Cl
B.G分子中含有两个手性碳原子
C.化合物C中所有原子可能共平面
D.化合物E能发生取代、加成、氧化、还原反应
(2)化合物B的结构简式是________。
(3)E![]() F的化学方程式是________。
F的化学方程式是________。
(4)写出同时符合下列条件的化合物B(C12H12N2)两个同分异构体的结构简式________。
①分子中含有两个六元环;②1H-NMR谱显示有3个峰。
(5)设计由D经两步反应得到E的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com