
【题目】请回答下列问题
(1)配平化学方程式。__FeCl3+__SO2+__H2O=__FeCl2+__H2SO4+__HCl。
(2)除去括号中的杂质,写出除杂反应的离子方程式
①Na2SO4溶液(Na2CO3):_______________________________________________。
②Ca(NO3)2溶液(CaCl2):_______________________________________________。
(3)写出下列反应的离子方程式:
①向烧碱溶液中通入少量CO2气体:_______________________________________________。
②向澄清石灰水中滴加足量的碳酸氢钠溶液:_______________________________________________。
(4)实验室中,制取Fe(OH)3胶体的离子方程式是_______________________________________________,
证明胶体已经制成的方法是_______________________________________________。
【答案】2 1 2 2 1 2 CO32+2H+=CO2↑+H2O Ag++Cl=AgCl↓ CO2+2OH-=CO32-+H2O; Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 丁达尔效应
Fe(OH)3(胶体)+3H+ 丁达尔效应
【解析】
(1)依据氧化还原反应的规律结合电子转移数守恒、原子守恒配平;
(2)①碳酸钠能够与硫酸反应生成硫酸钠、二氧化碳和水;
②硝酸银与氯化钙反应生成氯化银沉淀和硝酸钙;
(3)①烧碱和少量二氧化碳反应会生成碳酸钠与水;
②向澄清石灰水中滴加足量的碳酸氢钠溶液生成碳酸钠、碳酸钙和水;
(4)实验室中,向沸水中逐滴加入饱和氯化铁溶液可制取Fe(OH)3胶体;利用胶体特有的性质检验。
(1)方程式中FeCl3转化为FeCl2,铁元素化合价从+3降低到+2,得到电子数为1,SO2转化为H2SO4,S元素化合价从+4价升高到+6价,失去电子数为2,则依据电子转移数守恒可知,FeCl3与FeCl2的化学计量数为2,SO2与H2SO4的化学计量数为1,再根据Cl和H原子守恒可知,HCl和H2O的化学计量数分别为2,故该反应的化学方程式为:2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl,故答案为:2;1;2;2;1;2;
①碳酸钠能够与硫酸反应生成硫酸钠、二氧化碳和水,离子方程式:CO32+2H+=CO2↑+H2O,可以用稀硫酸除去硫酸钠中的碳酸钠;
故答案为:CO32+2H+=CO2↑+H2O;
②硝酸银与氯化钙反应生成氯化银沉淀和硝酸钙,离子方程式:Ag++Cl=AgCl↓,可以用硝酸银除去硝酸钙中的氯化钙,
故答案为:Ag++Cl=AgCl↓;
(3)①向烧碱溶液中通入少量CO2气体发生的离子方程式为:CO2+2OH-=CO32-+H2O;
②向澄清石灰水中滴加足量的碳酸氢钠溶液发生的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
(4)实验室中,制取Fe(OH)3胶体的操作是向沸水中滴加几滴饱和氯化铁溶液,继续加热,直至溶液变成红褐色,停止加热;该反应的离子方程式是Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;证明胶体已经制成的方法是使用光束通过该分散系,若出现“光亮”的通路,则证明该胶体已制成,即丁达尔效应,
Fe(OH)3(胶体)+3H+;证明胶体已经制成的方法是使用光束通过该分散系,若出现“光亮”的通路,则证明该胶体已制成,即丁达尔效应,
故答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;丁达尔效应。
Fe(OH)3(胶体)+3H+;丁达尔效应。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】将某植物的叶肉细胞链于适宜沮度和充足的14CO2条件下,先给予一段时间光照,然后再停止光照,检测整个过程叶肉细胞的叶绿体中放射性C3浓度的变化情况,结果如下图.回答下列问题。
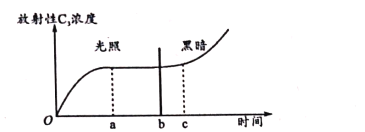
(1)叶肉细胞以14CO2为原料,生成C3的场所是____。图中a~b段放射性C3浓度基本不变,原因是____。
(2)图示结果显示,停止光照后的b~c时间段内,叶肉细胞中放射性C3的浓度并没有上升,原因是____。
(3)某实验小组对叶肉细胞交替进行光照和黑暗处理(先光照后黑暗,每次光照与黑暗处理的时间相同;各组光照强度和处理的总时间也相同),随着光照和黑暗交替频率的增加,推测叶肉细胞光合作用中CO2的同化总量最可能____(填增加或减少或不变),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2和Na2CO3组成的固体混合物与200mL稀盐酸刚好反应完全后,收集到标准状况下的气体3.36L,所得溶液中含NaCl 0.4mol,下列说法错误的是
A.稀盐酸的物质的量浓度是2 mol/L
B.原固体混合物中Na2O2的质量是7.8g
C.上述反应过程中,Na2O2和Na2CO3产生气体的体积比为1:1
D.该混合气体的平均摩尔质量为40 g/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为

A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com