
【题目】硝酸是重要的化工原料,在工农业生产和国防上有重要用途。
(1)实验室利用硝石(NaNO3)和浓硫酸共热制取硝酸。
①该反应利用了浓硫酸的_______性;
②该反应的温度不宜太高,原因是(用化学方程式表示)______;
(2)工业上用氨气的催化氧化法制取硝酸,再利用硝酸和氨气反应生产NH4NO3。
①写出氨气的电子式_____;
②写出氨气催化氧化的化学方程式_______;
③在生产过程中,氨催化氧化生成氮氧化物的利用率是80%,氮氧化物被吸收得到硝酸的利用率是85%,则制取80 t的NH4NO3需要氨气______t;
(3)某混合酸1L中含1mol的硝酸和2mol的硫酸。取该混合酸100mL,加入5.6g铁粉充分反应。
①反应中可以生成NO____L(标准状况);
②向反应后的溶液再加入铁粉,能继续溶解铁粉____g。
【答案】高沸点性(或不挥发性) 4HNO3= 4NO2 ↑ + O2 ↑ + 2H2O ![]() 4NH3+ 5O2
4NH3+ 5O2 ![]() 4NO + 6H2O 42 2.24 5.6
4NO + 6H2O 42 2.24 5.6
【解析】
(1)利用浓硫酸的高沸点分析;
(2)根据 硝酸不稳定能分解分析;
(3)根据氨气转化为硝酸的一系列反应分析氨气的质量。
(4)注意硝酸具有强氧化性,硫酸具有酸性,同时注意铁离子能与铁反应。
(1) ①浓硫酸制取硝酸时利用浓硫酸的高沸点性(或不挥发性);
②硝酸在温度高时能分解生成二氧化氮和氧气和水,方程式为: 4HNO3= 4NO2 ↑ + O2 ↑ + 2H2O;
(2). ①氨气的电子式为:![]() ;
;
②氨气和氧气反应生成一氧化氮和水,方程式为: 4NH3+ 5O2 ![]() 4NO+ 6H2O ;
4NO+ 6H2O ;
③NH3-NO-HNO3-NH4NO3,80 t的NH4NO3需要转化为硝酸的的氨气的质量为![]() =25t,另外需要和硝酸反应的氨气的质量为
=25t,另外需要和硝酸反应的氨气的质量为![]() =17t,总共氨气的质量为25+17=42t;
=17t,总共氨气的质量为25+17=42t;
(3). ①反应的离子方程式为Fe+4H++NO3-=Fe3++NO![]() +2H2O,根据铁的物质的量为0.1mol,溶液中的氢离子为0.5mol,硝酸根离子为0.1mol分析,铁反应生成0.1mol一氧化氮,标况下的体积为 2.24L;
+2H2O,根据铁的物质的量为0.1mol,溶液中的氢离子为0.5mol,硝酸根离子为0.1mol分析,铁反应生成0.1mol一氧化氮,标况下的体积为 2.24L;
② 反应中消耗0.4mol氢离子,和0.1mol硝酸根离子,还剩余0.1mol氢离子和0.1mol铁离子,0.1mol氢离子能反应0.05mol铁,0.1mol铁离子能反应0.05mol铁,故总共反应0.1mol铁,质量为5.6g。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L SO3含有NA个分子
B.常温常压下 4.4 g乙醛所含σ键数目为0.6 NA
C.密闭容器中2 mol NO与1 mol O2充分反应,产物分子数为2 NA
D.18 g D2O中含有的质子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚,俗称扑热息痛,具有很强的解热镇痛作用,工业上通过下列方法合成(B1和B2、C1和C2分别互为同分异构体,无机产物略去):
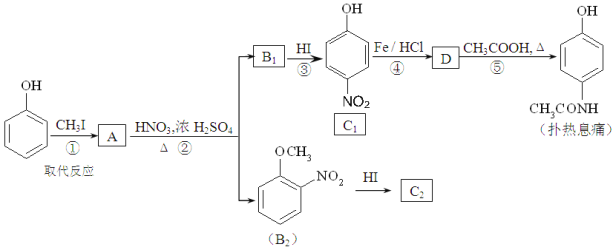
已知:
请回答下列问题:
(1)A的结构简式为 ______________,C2的结构简式为 _________________。
(2)上述②~⑤的反应中,属于取代反应的有________________(填数字序号)。
(3)工业上不是直接用硝酸氧化苯酚得到C1,而是设计反应①、②、③来实现,其目的是________________________________________________。
(4)反应⑤的化学方程式为_____________________________________________。
(5)扑热息痛有多种同分异构体,其中符合下列条件的同分异构体共有______种。
a.苯环上只有两个取代基,其中一个含碳不含氮,另一个含氮不含碳;
b.两个氧原子与同一个原子相连。
其中核磁共振氢谱中只出现四组峰,且峰面积比为3:2:2:2,又不能发生水解反应的同分异构体的结构简式为_____________________________。其中既能发生银镜反应,也能分别与盐酸、氢氧化钠溶液反应,在核磁共振氢谱中只出现五组峰的同分异构体的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
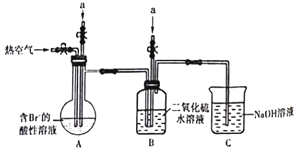
A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用阿伏伽德罗定律及其推论,按要求填空:
(1)标准状况下,5L CH4气体与5L NH3气体的原子个数之比为______________;
(2)同温、同压下,不同体积的N2和CO气体密度之比为______________;
(3)同温、同压下,等质量的一氧化碳和二氧化碳的体积之比为______________;
(4)同温、同压下,等体积的N2和O2的质量比为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
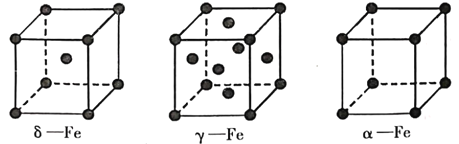
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或名称表述不正确的是( )
A.葡萄糖的分子式:C6H12O6
B.HCl的电子式:![]()
C. 的名称:2﹣甲基丙烷
的名称:2﹣甲基丙烷
D.含有10个中子的氧原子可表示为:![]() O
O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com