
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物,“速力菲”(主要成分为的琥珀酸亚铁,即丁二酸亚铁)是市场上一种常用的补铁药物,它难溶于水,但在人体胃酸的作用下可以释放出Fe2+,从而被人体吸收。
(1)某同学为了检验其中的Fe2+,将药物研磨、水溶后过滤。
①如图是某学生的过滤操作示意图,其操作不规范的是___(填标号)

a.玻璃棒用作引流
b.漏斗末端颈尖未紧靠烧杯壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中搅动以加快过滤速度
②取少量所得滤液,分别加入 K3Fe(CN)6溶液(一种检验Fe2+的试剂)和KSCN溶液(一种检验Fe3+的试剂),均未出现明显现象。其主要原因是___。
(2)取酸性环境下“速力菲”溶解过滤后的滤液敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色说明有Fe3+生成,说明Fe2+___。
(3)医生通常会建议:与维生素C同时服用,能增强“速力菲”的补铁效果。此举是利用了维生素C的___。(填“氧化性”、“还原性”或“碱性”)
【答案】bde 补铁药物“速力菲”难溶于水 容易被氧化为Fe3+(或具有强还原性) 还原性
【解析】
(1)①根据过滤操作的要求进行分析;
②药物主要成分为的琥珀酸亚铁,即丁二酸亚铁,琥珀酸亚铁难溶于水,故滤液中不含亚铁离子或铁离子;
(2)酸性环境下“速力菲”溶解过滤后的滤液中含有![]() ,敞口放置在空气中一段时间,被氧化为铁离子;
,敞口放置在空气中一段时间,被氧化为铁离子;
(3)维生素C有还原性,能将铁离子还原为亚铁离子。
(1)①a. 玻璃棒用作引流,使液体顺利流下,a正确;
b. 漏斗末端颈尖未紧靠烧杯壁,漏斗末端颈尖应紧靠烧杯壁,故b错误;
c. 将滤纸湿润,使其紧贴漏斗壁,防止液体从滤纸与漏斗的缝隙流下,故c正确;
d. 滤纸边缘应低于漏斗上边缘,故d错误;
e. 玻璃棒不能在漏斗搅动,可能捣破滤纸,过滤失败,故e错误;
②药物主要成分为的琥珀酸亚铁,即丁二酸亚铁,琥珀酸亚铁难溶于水,故滤液中不含亚铁离子或铁离子,所以加入![]() 溶液和
溶液和![]() 溶液,均未出现明显现象,
溶液,均未出现明显现象,
答案为:bde;补铁药物“速力菲”难溶于水;
(2)酸性环境下“速力菲”溶解过滤后的滤液中含有![]() ,敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色,说明
,敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色,说明![]() 被空气中的氧气氧化生成了
被空气中的氧气氧化生成了![]() ,因此说明
,因此说明![]() 容易被氧化,或还原性很强;
容易被氧化,或还原性很强;
故答案为:容易被氧化为Fe3+(或具有强还原性);
(3)维生素C有还原性,能将铁离子还原为亚铁离子,人体能够吸收亚铁离子,与维生素C同时服用,能增强“速力菲”的补铁效果。
故答案为:还原性。


科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
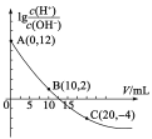
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
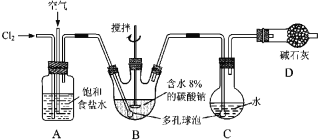
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是________________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是____________________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用_____取20.00 mL次氯酸溶液,加入足量的_________________,再加入足量的_______________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1moI/L的是
A. 将6.2gNa2O溶解于水,并配成200mL溶液
B. 1L含1mol K+的K2SO4溶液
C. 将22.4LHC1溶于1L水
D. 将40.0 g NaOH溶于1L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol,若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为______ 个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A |
| 通过观察液面差判断该装置的气密性 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量MgO粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | 说明Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 说明铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com