
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol,若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为______ 个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为______ mol/L。
【答案】![]()
![]()
【解析】
(1)根据n=![]() 计算气体的物质的量,由于是双原子分子,故原子物质的量为分子的2倍,再根据N=n·NA计算原子数目;
计算气体的物质的量,由于是双原子分子,故原子物质的量为分子的2倍,再根据N=n·NA计算原子数目;
(2)根据溶液质量等于溶剂质量与溶质质量和,结合溶液的密度计算出溶液的质量分数,再根据c=![]() 计算所得溶液的物质的量浓度。
计算所得溶液的物质的量浓度。
(1)n(气体)=![]() mol,故n(原子)=2n(气体)=2×
mol,故n(原子)=2n(气体)=2×![]() mol,则N(原子)=2×n(原子)l×NAmol-1=2×
mol,则N(原子)=2×n(原子)l×NAmol-1=2×![]() mol×NAmol-1=
mol×NAmol-1=![]() ;
;
(2)该气体溶于水1L水后,溶液的质量m(溶液)=1000g+mg=(1000+m)g,溶液的体积V=![]() cm3=
cm3=![]() ×10-3L,溶质的质量分数为
×10-3L,溶质的质量分数为![]() ,则根据物质的量浓度与质量分数换算关系可知其溶液的物质的量浓度c=
,则根据物质的量浓度与质量分数换算关系可知其溶液的物质的量浓度c=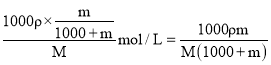 mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式________________。
(2)C1O2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂。KClO3与SO2在强酸性溶液中反应可制得C1O2,此反应的离子方程式为_________________。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为___________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度______ (填“大”或“小”)。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应每生成1 molNa2FeO4转移____mol电子。
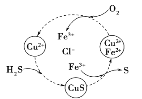
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是_______。该图示的总反应为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物,“速力菲”(主要成分为的琥珀酸亚铁,即丁二酸亚铁)是市场上一种常用的补铁药物,它难溶于水,但在人体胃酸的作用下可以释放出Fe2+,从而被人体吸收。
(1)某同学为了检验其中的Fe2+,将药物研磨、水溶后过滤。
①如图是某学生的过滤操作示意图,其操作不规范的是___(填标号)

a.玻璃棒用作引流
b.漏斗末端颈尖未紧靠烧杯壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中搅动以加快过滤速度
②取少量所得滤液,分别加入 K3Fe(CN)6溶液(一种检验Fe2+的试剂)和KSCN溶液(一种检验Fe3+的试剂),均未出现明显现象。其主要原因是___。
(2)取酸性环境下“速力菲”溶解过滤后的滤液敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色说明有Fe3+生成,说明Fe2+___。
(3)医生通常会建议:与维生素C同时服用,能增强“速力菲”的补铁效果。此举是利用了维生素C的___。(填“氧化性”、“还原性”或“碱性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8g H218O含有的中子数为NA
B. 0.1mol·L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA
C. 0.1mol 的CH4和NH3混合气体,含有的共价键数目为0.4NA
D. 4.6g Na与含0.1mol HCl的稀盐酸充分反应,转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中铁元素被还原的是( )
A.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
B.Fe+CuSO4=Cu+FeSO4
C.Fe(OH)3+3HCl=FeCl3+3H2O
D.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室常用的部分仪器,请回答下列问题

(1)序号为⑧和⑩的仪器名称分别为__________、__________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应仪器且可直接加热的仪器上述中的___________(填名称)。
(4)在配制一定物质的量浓度的溶液时,需要用到的仪器是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1∶2的是( )
A. 3S+6NaOH===2Na2S+Na2SO3+3H2O
B. 2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C. 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. I2+2NaClO3===2NaIO3+Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是

A.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ mol-1
B.P4(s,白磷) = 4P(s,红磷) ΔH>0
C.白磷比红磷稳定
D.以上变化中,白磷和红磷所需活化能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
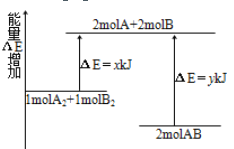
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com