
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是

A.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ mol-1
B.P4(s,白磷) = 4P(s,红磷) ΔH>0
C.白磷比红磷稳定
D.以上变化中,白磷和红磷所需活化能相等
【答案】A
【解析】
A. 如图所示,反应物的总能量大于生成物的总能量,为放热反应,ΔH= E生- E反,E3生成物的总能量,E2为反应物的总能量,红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH= -(E2-E3)kJ mol-1,故A正确;
B. 如图所示,白磷的能量高于红磷的能量,反应P4(s,白磷) = 4P(s,红磷)为放热反应,ΔH<0,故B错误;
C. 能量越低越稳定,如图所示,白磷的能量高于红磷的能量,则红磷比白磷稳定,故C错误;
D. 白磷和红磷的分子结构不同,化学键的连接方式不同,由稳定分子变为活化分子需要的能量也不同,则二者需要的活化能不相等,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol,若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为______ 个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四位同学同时进行反应![]() 的速率测定实验,分别测得反应速率如下:
的速率测定实验,分别测得反应速率如下:
①v(A)=0.15mol/(Ls),②v(B)=0.6mol/(Ls),③v(C)=0.4mol/(Ls),④v(D)=0.45mol/(Ls)。其中反应进行得最快的是( )
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等。
(1)下列ΔH表示物质燃烧热的是_____(填ΔH1、ΔH2或ΔH3,下同);表示中和热的是____。
A. 2H2(g)+O2(g)=2H2O(l) ΔH1
B. C(s)+ O2(g)=CO(g) ΔH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3
D. C(s)+ O2(g)=CO2(g) ΔH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ΔH7
(2)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是(________)。
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=+2a kJ·mol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=-2a kJ·mol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=-4a kJ·mol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=+4a kJ·mol-1
(3)充分燃烧一定量丁烷(C4H10)放出热量161.9kJ,且生成的CO2恰好能与2.5mol/L 100mL的氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出能量为__________。
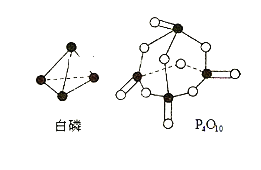
(4)进一步研究表明,化学反应能量变化与键能有关,键能简单理解断开1mol化学键吸收能量。下表是键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 197 | 360 | 499 | X |
已知白磷燃烧热为2378.0kJ·mol-1,则X=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A |
| 通过观察液面差判断该装置的气密性 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量MgO粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | 说明Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 说明铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL K2SO4和Al2(SO4)3的混合溶液,已知其中含Al3+1.08 g,SO42-6.72 g,则该溶液中K+的浓度为
A.0.1 mol/LB.0.15 mol/L
C.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com